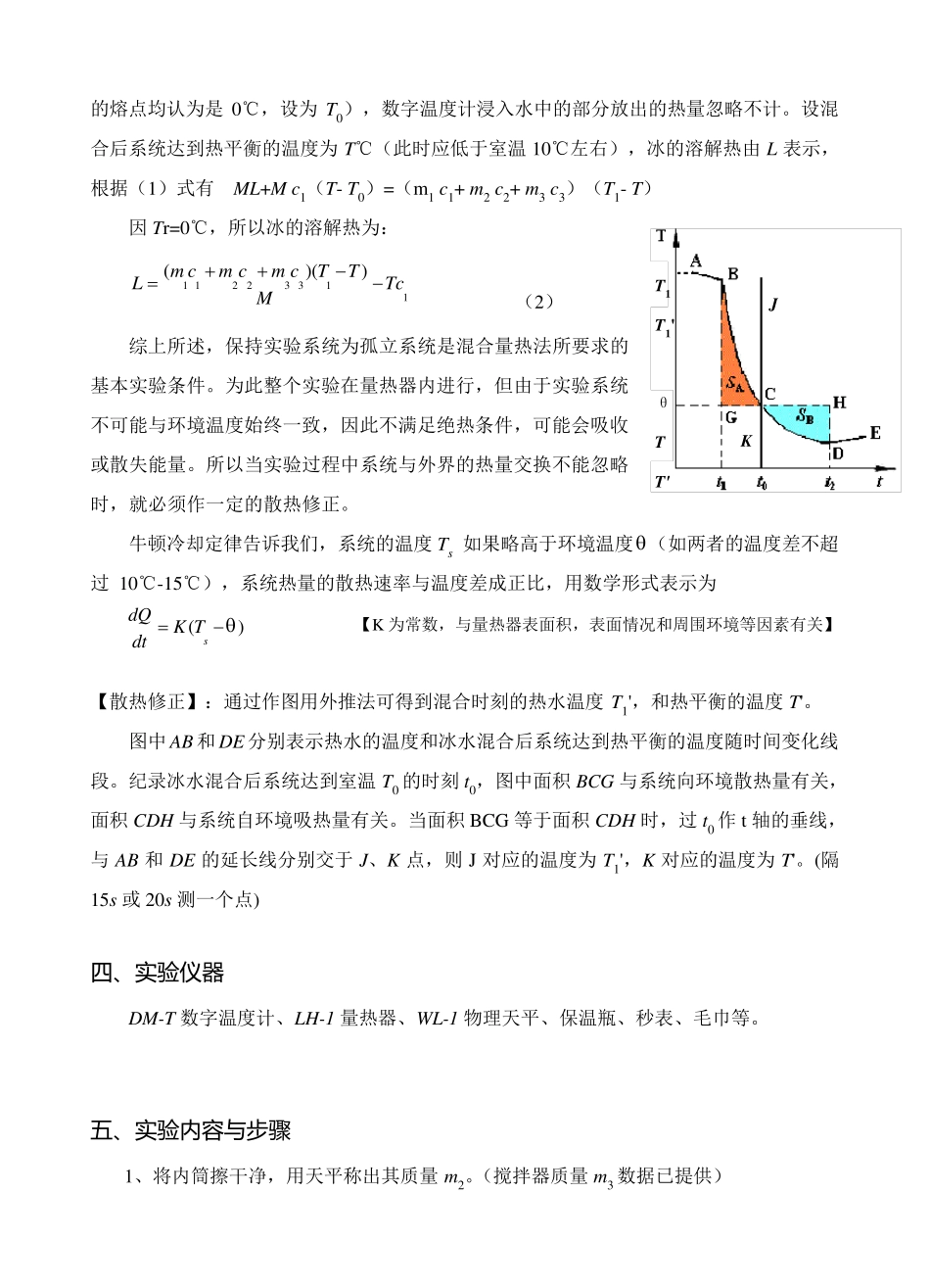
实 验 名 称 测 定 冰的熔解热 一 、前言 物质从固相转变为液相的相变过程称为熔解。一定压强下晶体开始熔解时的温度称为该晶体在此压强下的熔点。对于晶体而言,熔解是组成物质的粒子由规则排列向不规则排列的过程,破坏晶体的点阵结构需要能量,因此,晶体在熔解过程中虽吸收能量,但其温度却保持不变。物质的某种晶体熔解成为同温度的液体所吸收的能量,叫做该晶体的熔解潜热。 二、实验目的 1、学习用混合量热法测定冰的熔解热。 2、应用有物态变化时的热交换定律来计算冰的溶解热。 3、了解一种粗略修正散热的方法——抵偿法。 三、实验原理 本实验用混合量热法测定冰的熔解热。其基本做法如下:把待测系统 A 和一个已知热容的系统 B 混合起来,并设法使它们形成一个与外界没有热量交换的孤立系统 C(C=A+B).这样 A(或 B)所放出的热量,全部为 B(或 A)所吸收。因为已知热容的系统在实验过程中所传递的热量 Q,是可以由其温度的改变 △T 和热容 C 计算出来,即 Q = C△T ,因此待测系统在实验过程中所传递的热量也就知道了。 实验时,量热器装有热水(约高于室温 10℃,占内筒容积 1/2),然后放入适量冰块,冰溶解后混合系统将达到热平衡。此过程中,原实验系统放热,设为 Q放 ,冰吸热溶成水,继续吸热使系统达到热平衡温度,设吸收的总热量为 Q吸。 因为是孤立系统,则有 Q放= Q吸 (1) 设混合前实验系统的温度为 T1,其中热水质量为 m 1(比热容为 c1),内筒的质量为m 2(比热容为 c2),搅拌器的质量为 m 3(比热容为 c3)。冰的质量为 M(冰的温度和冰T T' θ J K T1 T1' 的熔点均认为是 0℃,设为 T0),数字温度计浸入水中的部分放出的热量忽略不计。设混合后系统达到热平衡的温度为 T℃(此时应低于室温 10℃左右),冰的溶解热由 L 表示,根据(1)式有 ML+M c1(T- T0)=(m1 c1+ m2 c2+ m3 c3)(T1- T) 因 Tr=0℃,所以冰的溶解热为: 1 1223 311()()m cm cm cTTLTcM (2) 综上所述,保持实验系统为孤立系统是混合量热法所要求的基本实验条件。为此整个实验在量热器内进行,但由于实验系统不可能与环境温度始终一致,因此不满足绝热条件,可能会吸收或散失能量。所以当实验过程中系统与外界的热量交换不能忽略时,就必须作一定的散热修正。 牛顿冷却定律告诉我们,系统的温度 Ts 如果略高于环境温度(如两者的温度...