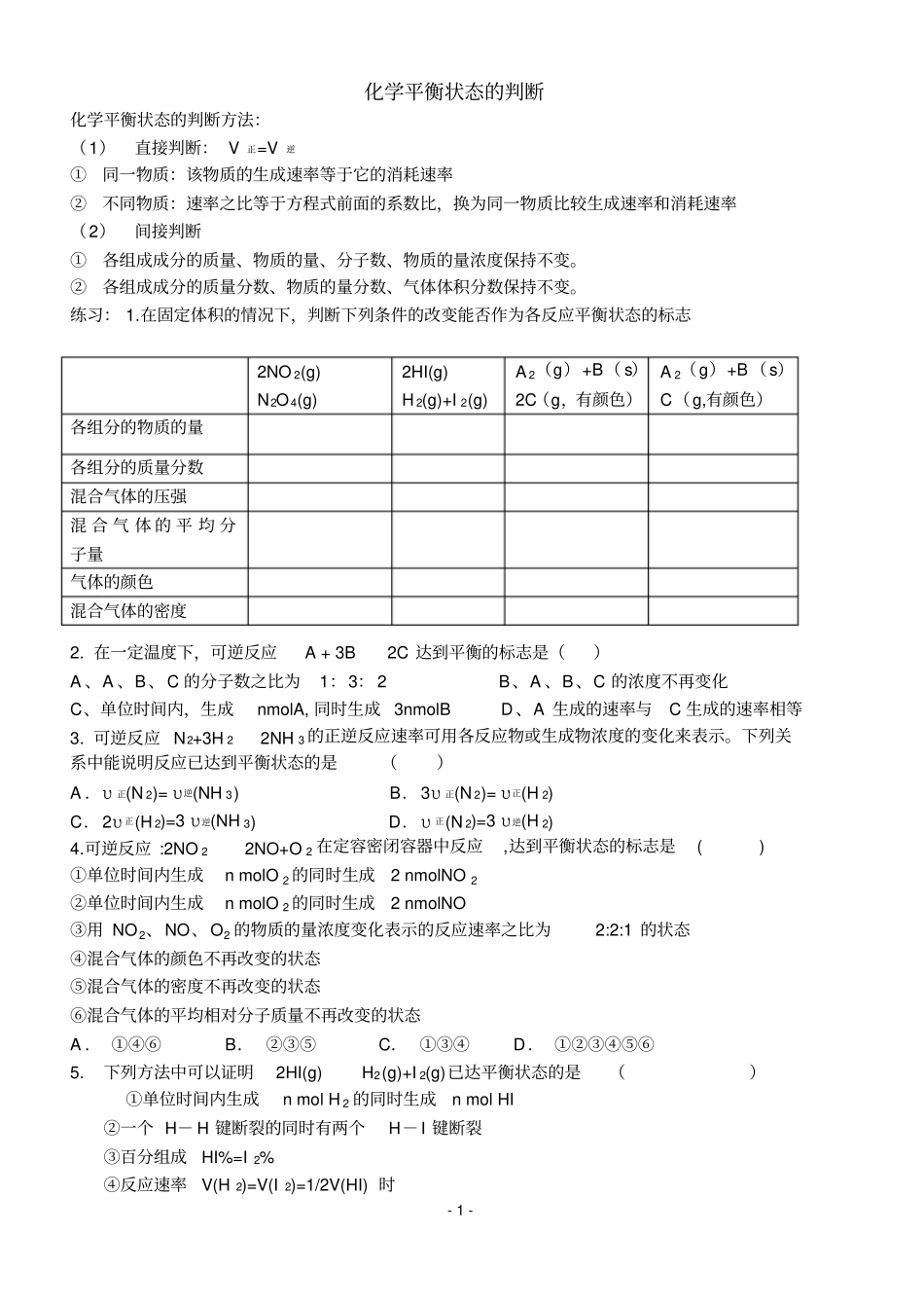
- 1 - 化学平衡状态的判断化学平衡状态的判断方法:(1)直接判断: V正=V逆①同一物质:该物质的生成速率等于它的消耗速率②不同物质:速率之比等于方程式前面的系数比,换为同一物质比较生成速率和消耗速率(2)间接判断①各组成成分的质量、物质的量、分子数、物质的量浓度保持不变。②各组成成分的质量分数、物质的量分数、气体体积分数保持不变。练习: 1.在固定体积的情况下,判断下列条件的改变能否作为各反应平衡状态的标志2. 在一定温度下,可逆反应A + 3B 2C 达到平衡的标志是()A 、A 、B、C 的分子数之比为1:3: 2 B、A 、B、C 的浓度不再变化C、单位时间内,生成nmolA, 同时生成 3nmolB D、A 生成的速率与C 生成的速率相等3. 可逆反应 N2+3H 22NH 3 的正逆反应速率可用各反应物或生成物浓度的变化来表示。下列关系中能说明反应已达到平衡状态的是()A .υ 正(N 2)= υ 逆(NH 3) B.3υ 正(N 2)= υ 正(H 2) C.2υ 正(H 2)=3 υ 逆(NH 3) D.υ 正(N 2)=3 υ 逆(H 2) 4.可逆反应 :2NO 22NO+O 2 在定容密闭容器中反应,达到平衡状态的标志是( ) ①单位时间内生成n molO 2 的同时生成2 nmolNO 2 ②单位时间内生成n molO 2 的同时生成2 nmolNO ③用 NO 2、NO、O2 的物质的量浓度变化表示的反应速率之比为2:2:1 的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的平均相对分子质量不再改变的状态A . ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥5. 下列方法中可以证明2HI(g) H2(g)+I 2(g)已达平衡状态的是()①单位时间内生成n mol H 2 的同时生成n mol HI ②一个 H- H 键断裂的同时有两个H-I 键断裂③百分组成HI%=I 2% ④反应速率V(H 2)=V(I 2)=1/2V(HI) 时2NO 2(g) N2O4(g) 2HI(g) H 2(g)+I 2(g) A 2(g)+B( s)2C(g,有颜色)A 2(g)+B(s)C(g,有颜色)各组分的物质的量各组分的质量分数混合气体的压强混 合 气 体 的 平 均 分子量气体的颜色混合气体的密度- 2 - ⑤[ HI ]∶[ H 2]∶[ I 2]=2∶2∶1 时⑥温度和体积一定时,某一生成物的浓度不再变化⑦温度和体积一定时,容器内压强不再变化⑧条件一定时,混合气体的平均相对分子质量不在变化⑨温度和体积一定时,混合气体颜色不再变化⑩温度和压强一定时,混合气体密度不再变化(2)在上述⑥ ~⑩的...