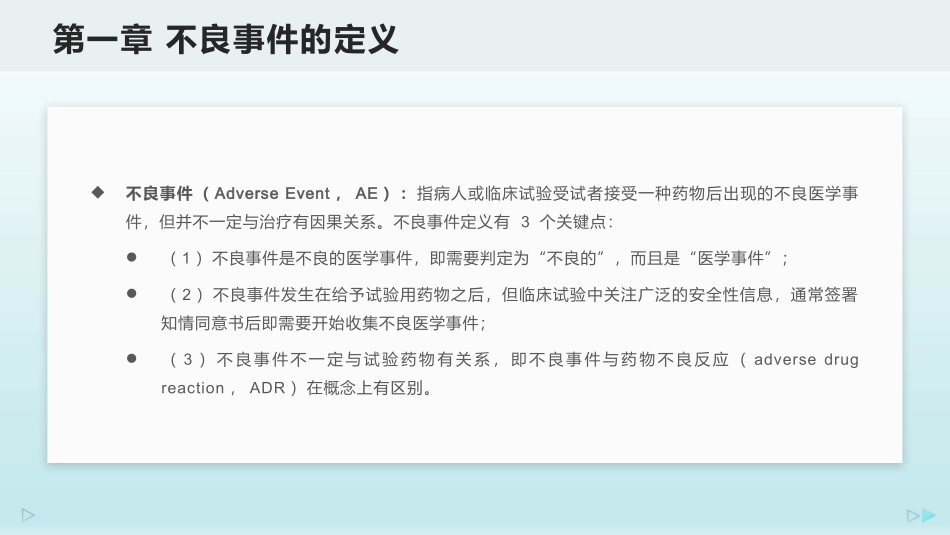
临床试验中的不良事件应如何处理汇报人:时间:2020年3月2020第三章严重不良事件处理原则第二章不良事件/严重不良事件的收集、记录及描述第一章不良事件的定义0103CONTENTS目录02不良事件(AdverseEvent,AE):指病人或临床试验受试者接受一种药物后出现的不良医学事件,但并不一定与治疗有因果关系。不良事件定义有3个关键点:(1)不良事件是不良的医学事件,即需要判定为“不良的”,而且是“医学事件”;(2)不良事件发生在给予试验用药物之后,但临床试验中关注广泛的安全性信息,通常签署知情同意书后即需要开始收集不良医学事件;(3)不良事件不一定与试验药物有关系,即不良事件与药物不良反应(adversedrugreaction,ADR)在概念上有区别。第一章不良事件的定义严重不良事件(SeriousAdverseEvent,SAE):当不良事件符合以下标准中的任意一项或者多项时,判断为严重不良事件:(1)导致死亡:当一个事件的结果为“死亡”,则可明确作为严重不良事件进行记录和报告;(2)危及生命:在此是指在发生不良事件时患者已经处于死亡的危险中,并不是指假设该不良事件如果更严重可能导致死亡;(3)导致住院或住院时间延长:需明确导致该状况的原因是由于不良事件所致,而非因择期手术、非医疗原因等导致入院;(4)导致永久或显著的残疾或功能障碍;(5)后代先天异常或致畸:受试者的后代存在先天异常和畸形等;(6)其他重要的医学事件:这些不良事件可能没有立刻威胁生命或者导致死亡,但可能危害患者或者可能导致需要干预性措施来预防上述结果的发生,需要基于医学的科学判断来决定。第一章不良事件的定义在不良事件和严重不良事件的收集与评价过程中,需要明确不良事件的名称、对事件进行描述、确定事件的起止时间,判断事件的严重程度以及进行评价等。不良事件名称的确定:不良事件的名称应该是医学术语,应优先使用医学诊断。如无法明确诊断,则使用症状/体征。当后期诊断明确时,对记录进行更新,以诊断取代之前的症状/体征。在确定不良事件名称时,应确保每个不良事件名称由单一的事件组成,一个诊断、体征/症状就是一个不良事件。因此,当受试者出现“上吐下泻”的症状,记录其不良事件名称时,应记录为两个不良事件,如(1)腹泻和(2)呕吐,不应将两个症状记录为一个“腹泻和呕吐”。第二章不良事件/严重不良事件的收集、记录及描述不良事件的开始时间:不同研究方案对不良事件发生时间的界定可能不同。在研究开始前,与申办方沟通,确保了解申办方的判断标准。有的研究以不良事件的“疾病诊断时间”为准,但以“出现症状的时间”作为不良事件开始时间更多见。从安全性评价的保守原则出发,以“出现症状的时间”作为开始时间更不易遗漏安全信息或低估安全隐患。根据以上原理,由不良事件进展为严重不良事件者,其严重不良事件的发生时间可以从不良事件发生时间开始计算,也有研究以不良事件升级为严重不良事件的日期开始作为严重不良事件的发生时间,时间判断的标准应当在方案中记录清楚。第二章不良事件/严重不良事件的收集、记录及描述不良事件的随访:应依据不良事件的严重程度、诊疗常规和试验方案要求来确定随访频次。如果本次访视未结束的不良事件,应在下次访视时再次询问及记录;如有合并用药,应收集并记录;如在当地医院进行诊治者,应尽量收集当地医院处理记录和用药信息。具体要求应符合所在医疗机构的相关SOP规定。不良事件的结束时间:应以不良事件痊愈、状态稳定、得到合理解释、受试者失访作为不良事件的结束时间。时间应尽量精确到年月日,如信息收集不全,也应具体到年月。如受试者死亡时,未收集到结束时间且并非导致死亡直接原因的不良事件仍然持续,则该不良事件的结束时间应空缺,状态为“持续”。如判断为导致“死亡”直接或主要原因的不良事件,结束时间为受试者死亡时间。第二章不良事件/严重不良事件的收集、记录及描述不良事件的转归:事件的结果可有如下状态:已恢复/痊愈;持续;未恢复/未痊愈;恢复/痊愈有后遗症;死亡;未知。不良事件的合并用药:用于治疗不良事件的合并用药应在原始病历...