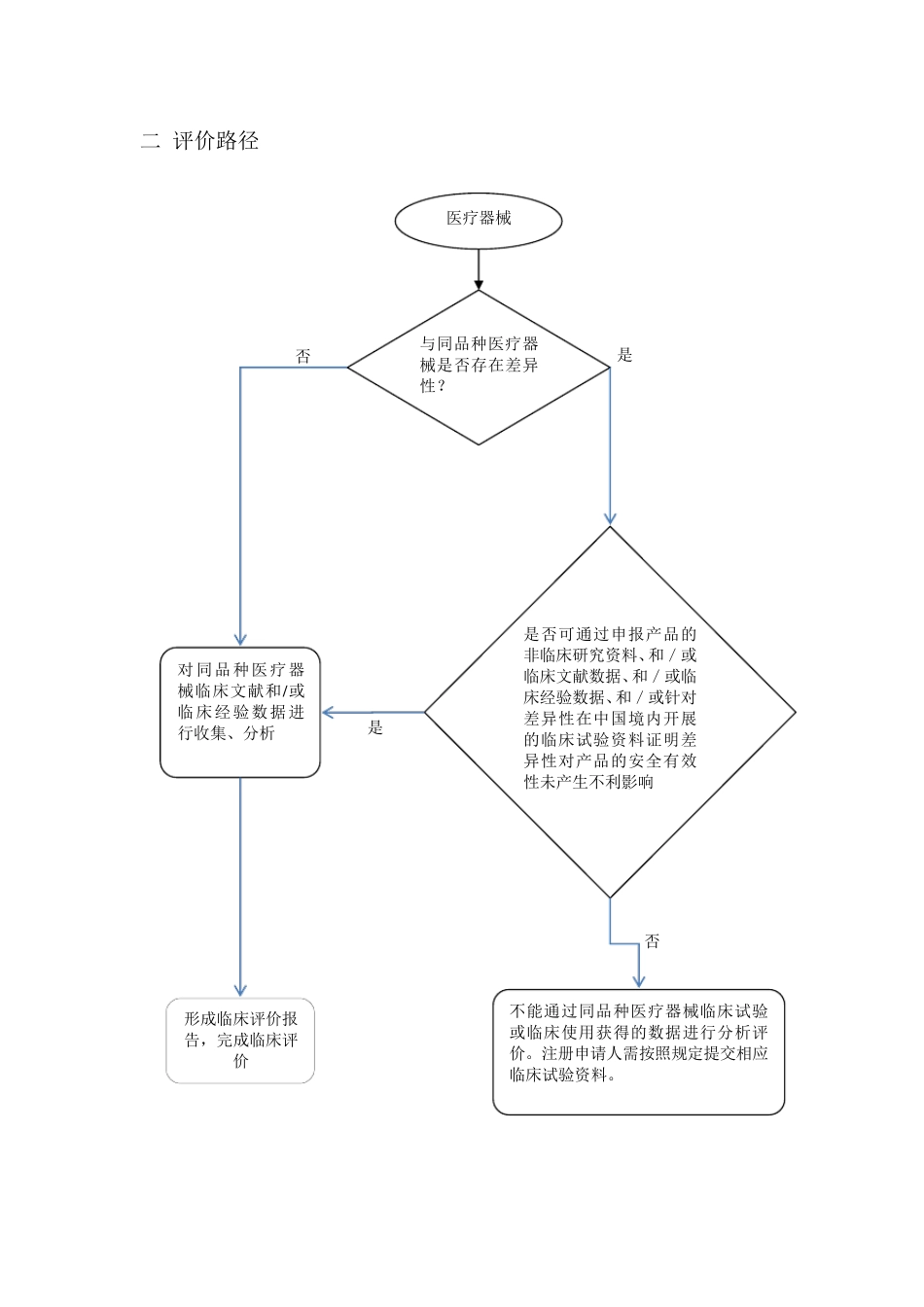
临床评价报告模板 一 同品种医疗器械判定 申报产品与某产品(注册证号:)基本原理、结构组成、与患者接触材料、生产工艺、安全性评价、符合的国家/行业标准、预期用途等方面完全相同,仅在 a,b 和 c 三项上略项有区别,但这些区别更有利于操作者的操作,不对产品的安全有效性产生不利影响,属于同品种医疗器械。对比信息见附件 附件 1 同品种医疗器械对比表 二 评价路径 医疗器械 与同品种医疗器械是否存在差异性? 是否可通过申报产品的非临床研究资料、和/或临床文献数据、和/或临床经验数据、和/或针对差异性在中国境内开展的临床试验资料证明差异性对产品的安全有效性未产生不利影响 对同品种医疗器械临床文献和/或临床经验数据进行收集、分析 不能通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价。注册申请人需按照规定提交相应临床试验资料。 是 否 否 是 形成临床评价报告,完成临床评价 申报产品与对比产品在基本原理、结构组成、与患者接触材料、生产工艺、安全性评价、符合的国家/行业标准、预期用途等方面完全相同,二者属于同品种医疗器械,二者的差异(a,b 和 c 三项)以非临床研究资料证明不对产品的安全有效性产生不利影响,并收集到足够的对比产品**临床文献、投诉和不良事件数据、临床风险相关的纠正措施数据和中国人群数据,以证明同品种产品的临床性能和安全性;最后根据《医疗器械临床评价技术指导原则》的要求形成《**临床评价报告》,完成临床评价。 三 分析评价 3.1 申报产品与同品种医疗器械相同 如表 1、表 2 所述,两产品在基本原理、结构组成、生产工艺、与人体接触部分的制造材料、安全性评价、产品符合国家/行业标准、使用范围、使用方法、禁忌症、消毒方式、包装、标签、产品说明书方面相同。 随着法规的更新,国家/行业标准的发布,其他同类产品注册 申请中审 评指导意 见 ,申报产品**符合的国家/行业标准更多 ,如电 磁 兼容 标准《GB/T 18268.1-2010 测 量 、控 制和实 验 室 用的电 设 备 电 磁兼 容 性要求 第 1 部分: 通 用要求》、《GB/T 18268.26-2010 测 量 、控制和实 验 室 用的电 设 备 电 磁 兼 容 性要求 第 26 部分:特 殊 要求 体外诊 断 (IVD)医疗设 备 》,在禁忌症、标签和说明书中都 有补 充 。 3.2 证明申报产品与同品种医疗器械的差异不对产品的安全有效性生产不利影响的...