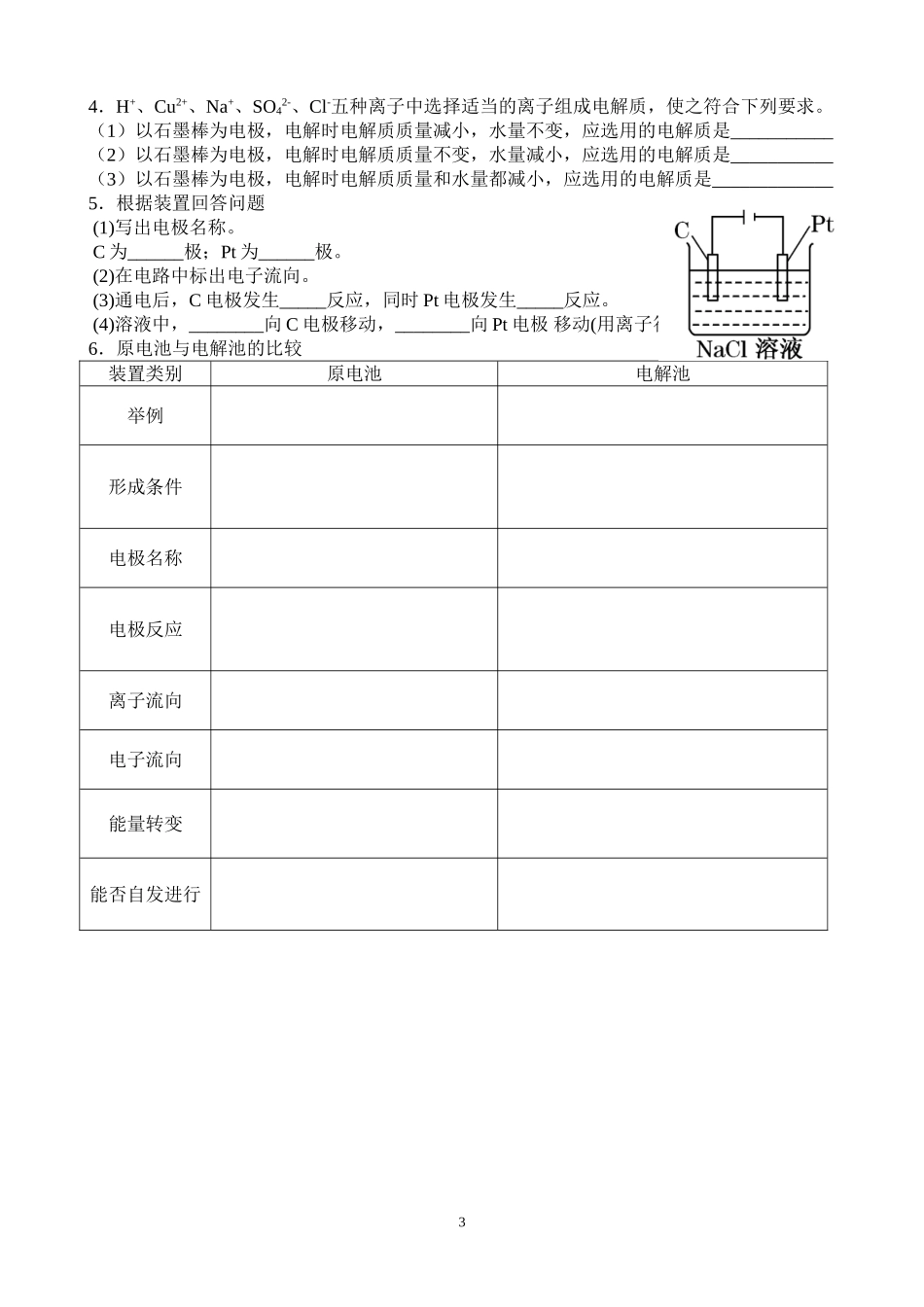
第四章第三节电解池(第一课时)课内探究案【学习目标】知识与技能:1.知道电解的基本原理,会判断一般的电解反应产物;2.能说出电解、电解池及形成条件;3.能正确使用实验器材,完成“电解池原理”实验操作。过程与方法:利用石墨电极电解氯化铜实验,探究电解原理。通过动手实验培养学生的观察、分析能力和解决实际问题的能力。情感态度价值观:通过在思考分析过程中相互讨论,相互启发,体会到合作交流的重要性。在实验探究的过程中享受学习的快乐,激发自己探索化学问题的兴趣,养成求真务实的科学态度。【学习重点】电解池的工作原理【学习难点】电解质溶液的电解规律【学法指导】通过知识回顾、实验感知、实验评价、迁移应用、归纳总结、练习巩固等方式理解并掌握电解池的原理【学习过程】【探究点一】工作原理实验探究:电解CuCl2溶液实验仪器:玻璃棒、石墨棒、导线、直流电源、改进的塑料制电解槽实验药品:CuCl2溶液、淀粉碘化钾试纸实验步骤:1.往电解槽中倒入约1/2的CuCl2溶液后将两根石墨棒浸入2.用导线将两根石墨棒与直流电源的正负极连接3.接通电源后,用玻璃棒把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近,观察试纸颜色的变化4.1min后,切断电源,观察阴极表面发生的变化。实验现象:阴极上:_________________________阳极上:_________________________,湿润的碘化钾淀粉试纸变____。实验结论:用石墨电极电解CuCl2溶液时,阴极析出________,阳极析出________。【归纳总结】1.离子的移动方向:2.电子的流动方向:3.电极反应式阳极:_____________________,发生_______反应阴极:_____________________,发生_______反应电池总反应式:_____________________________________。电解的实质:_______________________________________。【探究点二】电解质溶液的电解规律常见离子的放电顺序:阳极:_______________________________________________________________阴极:_______________________________________________________________【学以致用】1利用电解原理分析电解NaCl溶液电极反应式阳极:_____________________,发生_______反应阴极:_____________________,发生_______反应【巩固提升】如图所示,a、b均为石墨电极,电解质溶液为稀硫酸、Cu(NO3)2、NaCl的混合液,电解初期在a、b两极上析出的物质分别是()A:H2和Cl2B:Cl2和CuC:O2和H2D:O2和Cu变式:若将上题中的NaCl改为Na2SO4,则电解初期在a、b两极上析出的物质又分别是什么?【归纳总结】分析电解产物的一般思路【我的收获】【课后巩固】1.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是()A.原电池的正极和电解池的阳极所发生的反应;B.原电池的正极和电解池的阴极所发生的反应;C.原电池的负极和电解池的阳极所发生的反应;D.原电池的负极和电解池的阴极所发生的反应;2.用惰性电极实现电解,下列说法正确的是()A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶13.用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中正确的有()①该溶液的pH可能增大;②该溶液的pH可能减小;③该溶液的pH可能不变;④该溶液的浓度可能增大;⑤该溶液的浓度可能不变;⑥该溶液的浓度可能减小A.①②③B.①②③④C.①②③④⑤D.全部24.H+、Cu2+、Na+、SO42-、Cl-五种离子中选择适当的离子组成电解质,使之符合下列要求。(1)以石墨棒为电极,电解时电解质质量减小,水量不变,应选用的电解质是___________(2)以石墨棒为电极,电解时电解质质量不变,水量减小,应选用的电解质是___________(3)以石墨棒为电极,电解时电解质质量和水量都减小,应选用的电解质是_____________5.根据装置回答问题(1)写出电极名称。C为______极;Pt为______极。(2)在电路中标出电子流向。(3)通电后,...