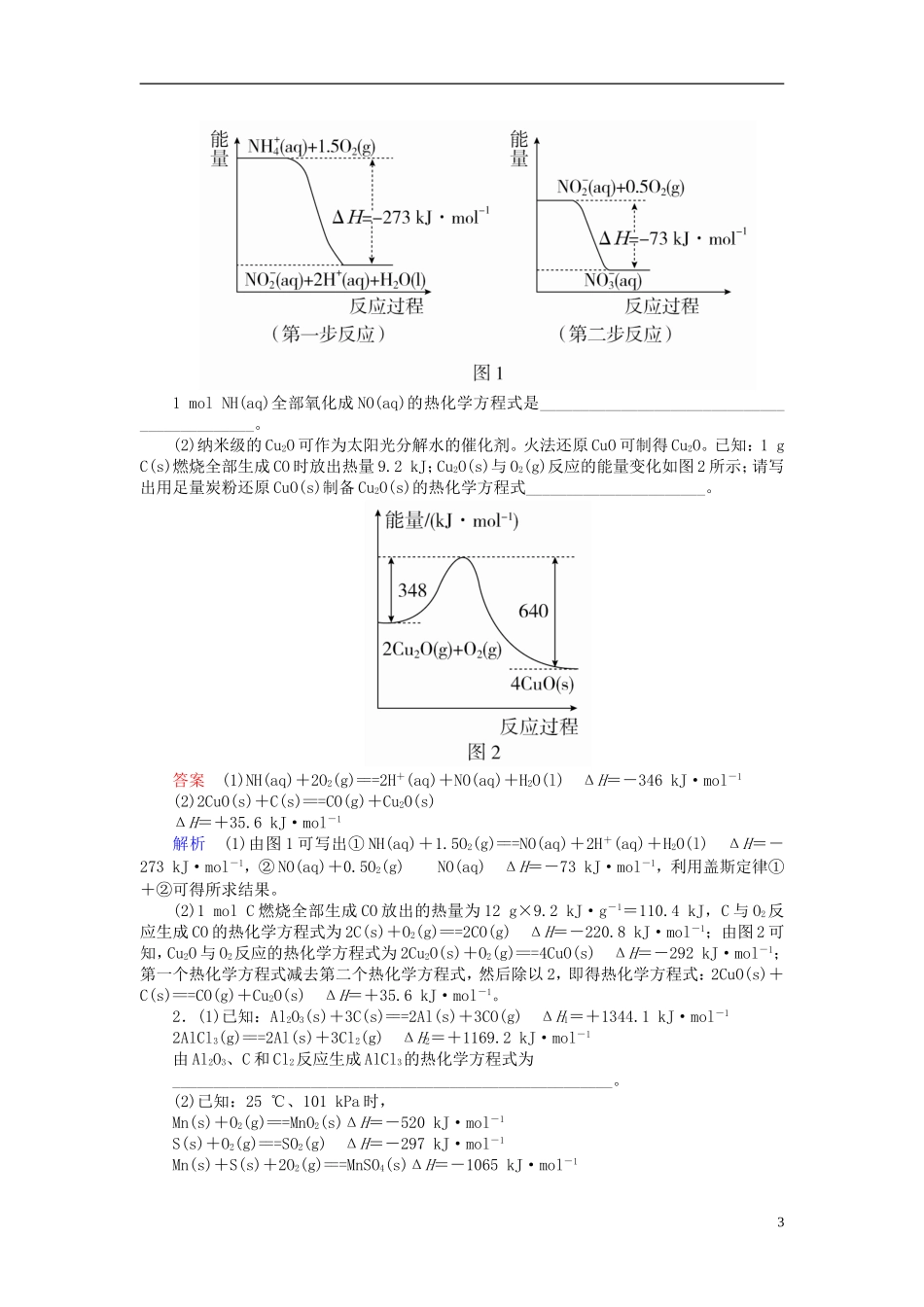
。。内部文件,版权追溯内部文件,版权追溯内部文件,版权追溯内部文件,版权追溯第2节盖斯定律及其应用考试说明理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。命题规律盖斯定律的应用是高考的常考考点,主要是盖斯定律应用于未知反应反应热的计算和未知反应的热化学方程式的书写,以填空题型出现。考点盖斯定律及其应用1.盖斯定律(1)内容:对于一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的。即:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。如:(2)意义:间接计算某些反应的反应热。已知在25℃、101kPa时:①C(s)+O2(g)===CO2(g)ΔH=-393.5kJ·mol-1,②2C(s)+O2(g)===2CO(g)ΔH=-221kJ·mol-1,则CO(g)+O2(g)===CO2(g)的ΔH为-283_kJ·mol-1。2.利用盖斯定律书写热化学方程式的步骤1(1)化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。(2)应用盖斯定律常用以下两种方法:①热化学方程式相加或相减,如由C(s)+O2(g)===CO2(g)ΔH1;C(s)+O2(g)===CO(g)ΔH2;可得2CO(g)+O2(g)===2CO2(g)ΔH=2(ΔH1-ΔH2)②合理设计反应途径,如甲,则ΔH=ΔH1+ΔH2。题组一利用盖斯定律书写热化学方程式1.(1)在微生物作用的条件下,NH经过两步反应被氧化成NO。两步反应的能量变化如图1所示:21molNH(aq)全部氧化成NO(aq)的热化学方程式是____________________________________________。(2)纳米级的Cu2O可作为太阳光分解水的催化剂。火法还原CuO可制得Cu2O。已知:1gC(s)燃烧全部生成CO时放出热量9.2kJ;Cu2O(s)与O2(g)反应的能量变化如图2所示;请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式______________________。答案(1)NH(aq)+2O2(g)===2H+(aq)+NO(aq)+H2O(l)ΔH=-346kJ·mol-1(2)2CuO(s)+C(s)===CO(g)+Cu2O(s)ΔH=+35.6kJ·mol-1解析(1)由图1可写出①NH(aq)+1.5O2(g)===NO(aq)+2H+(aq)+H2O(l)ΔH=-273kJ·mol-1,②NO(aq)+0.5O2(g)NO(aq)ΔH=-73kJ·mol-1,利用盖斯定律①+②可得所求结果。(2)1molC燃烧全部生成CO放出的热量为12g×9.2kJ·g-1=110.4kJ,C与O2反应生成CO的热化学方程式为2C(s)+O2(g)===2CO(g)ΔH=-220.8kJ·mol-1;由图2可知,Cu2O与O2反应的热化学方程式为2Cu2O(s)+O2(g)===4CuO(s)ΔH=-292kJ·mol-1;第一个热化学方程式减去第二个热化学方程式,然后除以2,即得热化学方程式:2CuO(s)+C(s)===CO(g)+Cu2O(s)ΔH=+35.6kJ·mol-1。2.(1)已知:Al2O3(s)+3C(s)===2Al(s)+3CO(g)ΔH1=+1344.1kJ·mol-12AlCl3(g)===2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·mol-1由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________________________________________________。(2)已知:25℃、101kPa时,Mn(s)+O2(g)===MnO2(s)ΔH=-520kJ·mol-1S(s)+O2(g)===SO2(g)ΔH=-297kJ·mol-1Mn(s)+S(s)+2O2(g)===MnSO4(s)ΔH=-1065kJ·mol-13SO2与MnO2反应生成无水MnSO4的热化学方程式是___________________________________________________。(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应。温度为T时,该反应的热化学方程式为_____________________________。已知温度为T时:CH4(g)+2H2O(g)===CO2(g)+4H2(g)ΔH=+165kJ·mol-1CO(g)+H2O(g)===CO2(g)+H2(g)ΔH=-41kJ·mol-1(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101kPa时:4Fe(s)+3O2(g)===2Fe2O3(s)ΔH=-1648kJ·mol-1C(s)+O2(g)===CO2(g)ΔH=-393kJ·mol-12Fe(s)+2C(s)+3O2(g)===2FeCO3(s)ΔH=-1480kJ·mol-1FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______________________________________________________。答案(1)Al2O3(s)+3C(s)+3Cl2(g)===2AlCl3(g)+3CO(g)ΔH=+174.9kJ·mol-1(2)MnO2(s)+SO2(g)===MnSO4(s)ΔH=-248kJ·mol-1(3)CO(g)+3H2(g)===CH4(g)+H2O(g)Δ...