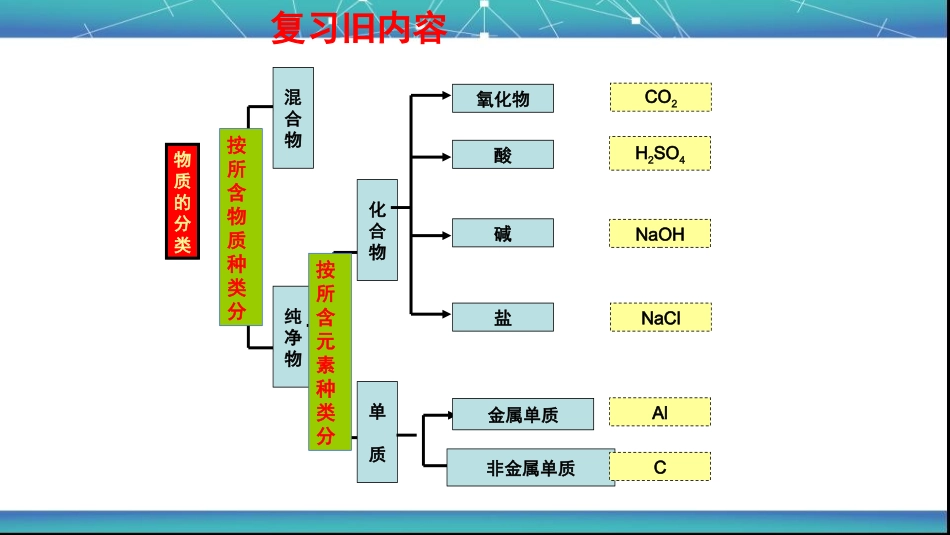
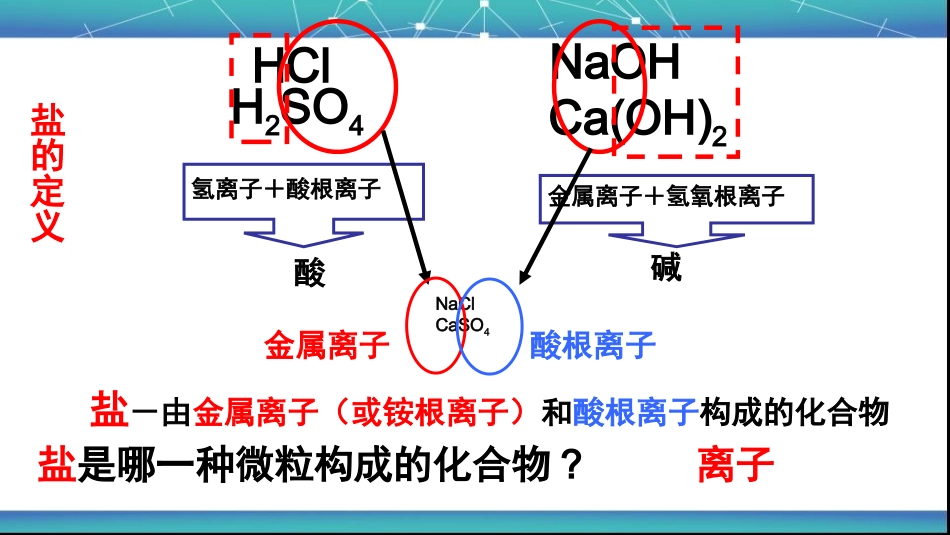
空白演示Loremipsumdolorsitamet,consecteturadipisicingelit.永登县西铁中学----薛忠鹏复习旧内容物质的分类混合物纯净物化合物单质金属单质非金属单质碱酸氧化物盐CAlNaClNaOHH2SO4CO2按所含物质种类分按所含元素种类分HClH2SO4NaOHCa(OH)2氢离子+酸根离子金属离子+氢氧根离子酸碱盐-由金属离子(或铵根离子)和酸根离子构成的化合物NaClCaSO4金属离子酸根离子盐是哪一种微粒构成的化合物?离子盐的定义请同学们回忆化学反应的实质是什么?分子破裂成原子,原子重新组合形成新的分子。盐的化学反应的实质是离子重新组合形成新的分子。比如:2H++CO32-=H2O+CO2↑,H++HCO3-=H2O+CO2↑OH-+NH4+=NH3↑+H2OMg2++2OH-==Mg(OH)2↓(白色沉淀)Cu2++2OH-=Cu(OH)2↓(蓝色沉淀)Fe3++3OH-=Fe(OH)3↓(红褐色沉淀)CO32-+Ba2+=BaCO3↓(白色沉淀)CO32-+2Ag+=Ag2CO3↓(白色沉淀)CO32-+Ca2+=CaCO3↓(白色沉淀)Cl-+Ag+=AgCl↓(白色沉淀)Ba2+SO42-=BaSO4↓(白色沉淀)盐的化学性质一:盐+酸碱指示剂---指示剂显色(1)大部分盐溶液显中性,不能使紫色石蕊溶液和酚酞溶液变色。(2)Na2CO3和NaHCO3溶液显碱性,能使紫色石蕊溶液显蓝色,使无色酚酞溶液显红色盐的化学性质思考:能用无色酚酞溶液鉴别NaOH溶液和Na2CO3溶液吗?不能盐的化学性质二:盐+金属---新盐+新金属(置换反应)判断下列反应能否在水中发生:①CuSO4+Zn---②AgNO3+Cu---③AgCl+Cu---④ZnSO4+Fe---①CuSO4+Zn=Cu+ZnSO4②2AgNO3+Cu=2Ag+Cu(NO3)2③不反应④不反应反应条件归纳:反应物:①盐能溶于水②前面的金属置换后面的金属③(K/Ca/Na除外)金属活动顺序表:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu金属活动性逐渐减弱CuSO4+Fe=FeSO4+Cu盐的化学性质三:盐+酸---新盐+新酸(复分解反应)(1)CaCO3(难溶)+HCl—(2)Na2CO3+H2SO4—(3)NaNO3+H2SO4—(4)AgCl(难溶)+HNO3—(5)BaCl2+H2SO4—(6)BaSO4(难溶)+HNO3—判断下列反应能否在水中发生:反应条件归纳:生成物:有气体或沉淀或水生成(5)BaCl2+H2SO4=BaSO4↓+2HCl(2)Na2CO3+H2SO4=Na2SO4+H2O+CO2↑(1)CaCO3+2HCl=CaCl2+H2O+CO2↑(3)不反应(4)不反应(6)不反应AgNO3+HCl=AgCl↓+HNO3盐的化学性质四:盐+碱---新盐+新碱(复分解反应)(1)KNO3+NaOH–(2)BaCO3+NaOH–(3)FeCl3+Ca(OH)2–(4)Na2CO3+Ca(OH)2–(5)Na2CO3+Cu(OH)2–判断下列反应能否在水中发生:(1)不反应(2)不反应(3)2FeCl3+3Ca(OH)2=2Fe(OH)3↓+3CaCl2(4)Na2CO3+Ca(OH)2=2NaOH+CaCO3↓(5)不反应反应条件归纳:反应物:溶于水,生成物:有气体或沉淀或水生成盐的化学性质五:盐+盐---新盐+新盐(复分解反应)(1)AgNO3+NaCl—(2)BaSO4+Na2CO3—(3)BaCl2+Na2CO3—(4)KNO3+NaCl—判断下列反应能否在水中发生:(1)AgNO3+NaCl=AgCl↓+NaNO3(2)不反应(3)BaCl2+Na2CO3=BaCO3↓+2NaCl(4)不反应反应条件归纳:反应物:溶于水,生成物:有沉淀生成盐的主要化学性质(可溶)(可溶)(可溶)(可溶)(可溶)2.盐+金属-新盐+新金属3.盐+酸-新盐+新酸4.盐+碱-新盐+新碱5.盐+盐-新盐+新盐课堂小结(活动性:金属>新金属)(K,Ca,Na除外)(有水或气体或沉淀生成)(有水或气体或沉淀生成)(有沉淀生成)1.盐+酸碱指示剂-指示剂显色(Na2CO3溶液和NaHCO3溶液)盐金属新盐+新金属(置换反应)酸新盐+新酸(复分解反应)新盐+新碱(复分解反应)盐新盐+新盐(复分解反应)碱2.有三瓶失去标签的无色溶液,只知逍它们分别是稀盐酸、澄清石灰水和氯化钠洛液中的各一种.下列四种试剂中,能将上述三种无色溶液一次鉴别出来的是()A.Na2CO3溶液B.MgCl2溶液C.KNO3溶液D.酚酞试液练习1-2(盐化学性质应用:物质鉴别)1.将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的()A、氯离子B、硫酸根离子C、碳酸根离子D、氢氧根离子CA3.下列各组物质,能在PH=1.5的溶液中大量共存,且形成无色溶液的是:()A.NaClBaCl2Na2SO4B.Na2CO3NaClNa2SO4C.CuSO4NaClNaNO3D.Na2SO4MgCl2KClD4.下列各组离子在溶液中一定能大量共存的是()A.H+、C1―、OH―B.Na+、Ca2+、CO32―C.Ag+、Cl―、NO3―D.H+、Fe2+、SO42―D练习3-4(盐化学性质应用:共存)写出由复分解反应制取下列物质的化学方程式⑴BaSO4⑵AgCl⑶CaCO3BaCl2+H2SO4=BaSO4↓+2HClAgNO3+HCl=AgCl↓+HNO3Ca(OH)2+Na2CO3=CaCO3↓+2NaOH练习5(盐化学性质应用:物质的转换)