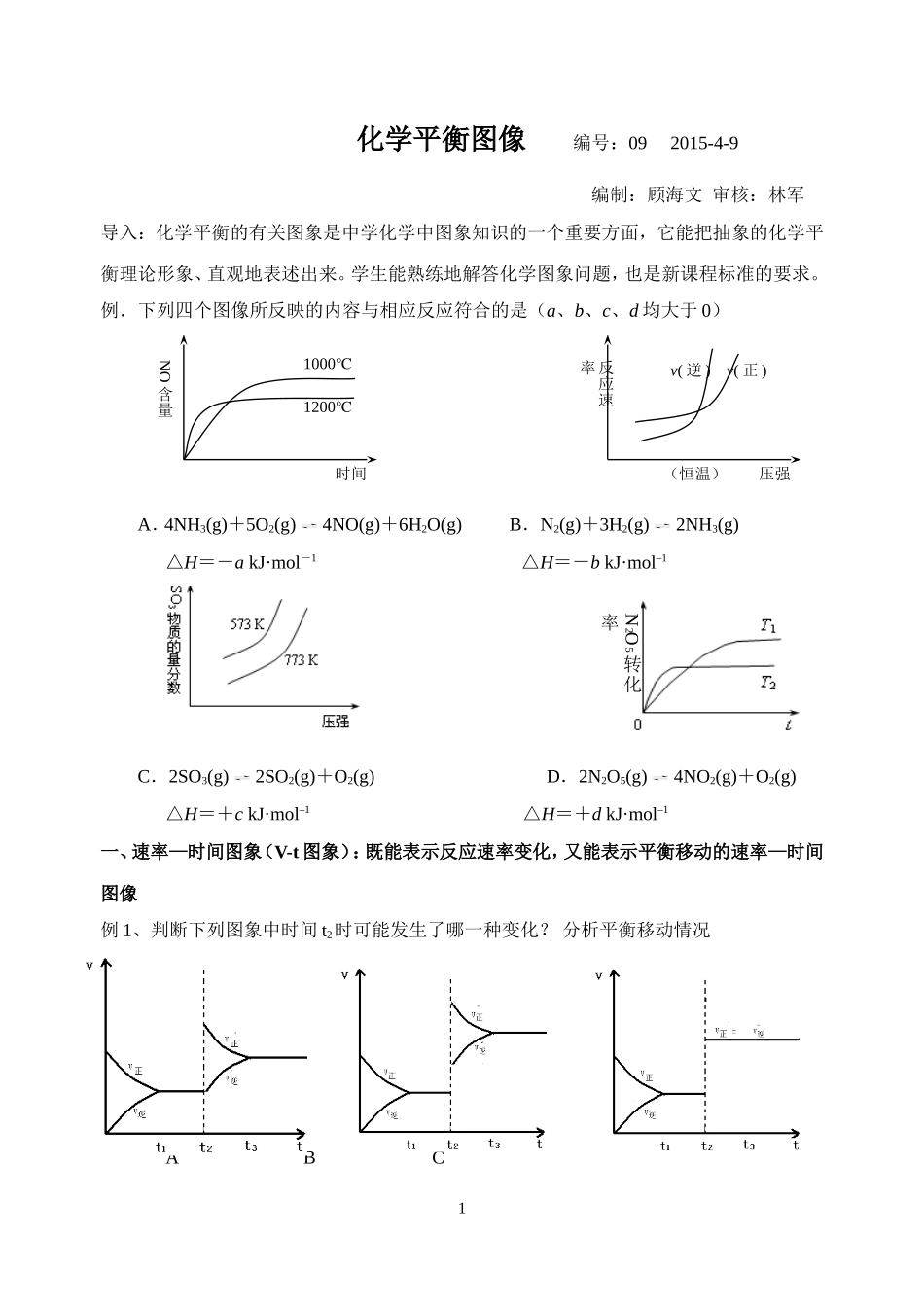
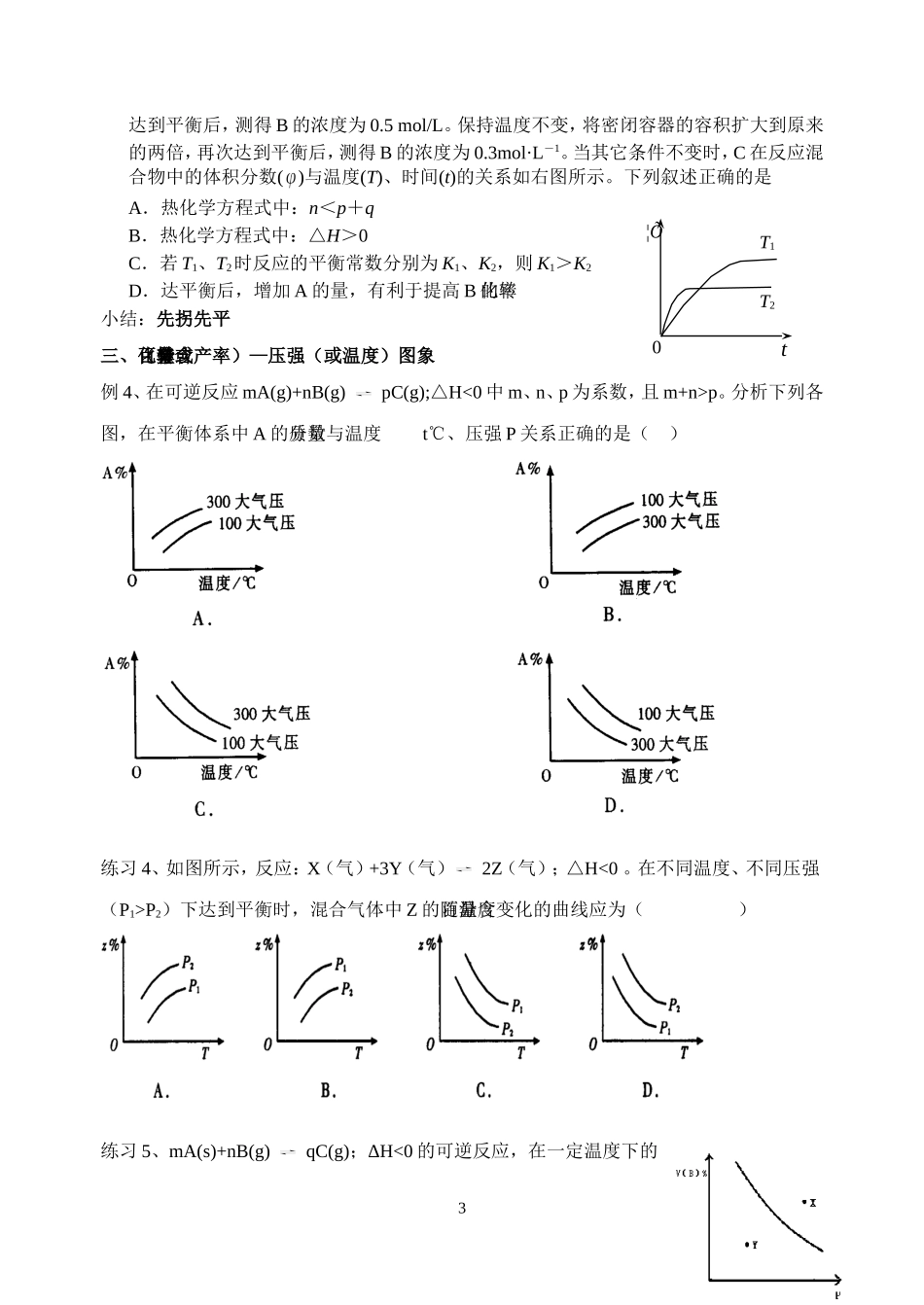
化学平衡图像编号:092015-4-9编制:顾海文审核:林军导入:化学平衡的有关图象是中学化学中图象知识的一个重要方面,它能把抽象的化学平衡理论形象、直观地表述出来。学生能熟练地解答化学图象问题,也是新课程标准的要求。例.下列四个图像所反映的内容与相应反应符合的是(a、b、c、d均大于0)A.4NH3(g)+5O2(g)4NO(g)+6H2O(g)B.N2(g)+3H2(g)2NH3(g)△H=-akJ·mol-1△H=-bkJ·mol–1C.2SO3(g)2SO2(g)+O2(g)D.2N2O5(g)4NO2(g)+O2(g)△H=+ckJ·mol–1△H=+dkJ·mol–1一、速率—时间图象(V-t图象):既能表示反应速率变化,又能表示平衡移动的速率—时间图像例1、判断下列图象中时间t2时可能发生了哪一种变化?分析平衡移动情况ABCNO含量时间1000℃1200℃反应速率(恒温)压强v(逆)v(正)1N2O5转化率例2、下图表示某可逆反应达到平衡过程中某一反应物的v—t图象,我们知道v=Δc/Δt;反之,Δc=v×Δt。请问下列v—t图象中的阴影面积表示的意义是()A、从反应开始到平衡时,该反应物的消耗浓度B、从反应开始到平衡时,该反应物的生成浓度C、从反应开始到平衡时,该反应物实际减小的浓度小结:某可逆反应达到平衡后,若增大反应物浓度,则v正,v逆,v正v逆,平衡移动。随着反应的进行,v正逐渐,v逆逐渐,反应进行一段时间后,v正v逆,重新建立新的平衡状态。二、转化率(或产率、百分含量等)—时间图象例3、可逆反应mA(s)+nB(g)pC(g)+qD(g)。反应中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如上图,根据图中曲线分析,判断下列叙述中正确的是()(A)达到平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,则平衡向逆反应方向移动(C)平衡后,增大A的量,有利于平衡正向移动(D)化学方程式中一定有n>p+q分析:T1T2,T1→T2,温度,C%,平衡移动,逆反应为反应练习1、右图中a曲线表示一定条件下的可逆反应:X(g)+Y(g)2Z(g)+W(s);△H=+QkJ/mol的反应过程。若使a曲线变为b曲线,可采取的措施是A、加入催化剂B、增大Y的浓度C、降低温度D、增大体系压强练习2、在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,在不同条件下R的百分含量R%的变化情况如下图,下列叙述正确的是()A、正反应吸热,L是气体B、正反应吸热,L是固体C、正反应放热,L是气体D、正反应放热,L是固体或液体练习3、一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:mA(s)+nB(g)pC(g)+qD(g)△H2达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数()与温度(T)、时间(t)的关系如右图所示。下列叙述正确的是A.热化学方程式中:n<p+qB.热化学方程式中:△H>0C.若T1、T2时反应的平衡常数分别为K1、K2,则K1>K2D.达平衡后,增加A的量,有利于提高B的转化率小结:先拐先平三、百分含量(转化率或产率)—压强(或温度)图象例4、在可逆反应mA(g)+nB(g)pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是()练习4、如图所示,反应:X(气)+3Y(气)2Z(气);△H<0。在不同温度、不同压强(P1>P2)下达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为()练习5、mA(s)+nB(g)qC(g);ΔH<0的可逆反应,在一定温度下的30t¦ÕT1T2密闭容器中进行,平衡时B的体积分数V(B)%与压强(P)关系如下图所示,下列叙述正确的是()A、m+nqC、X点时的状态,V正>V逆D、X点比Y点混和物的正反应速率慢练习6、图中的曲线是表示其他条件一定时,反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的是()A.a点B.b点C.c点D.d点小结:可逆反应:aX(s)+bY(g)cZ(g)+dW(g)达到平衡,混合物中Y的体积分数随压强(P)与温度T(T2>T1)的变化关系如图示。(定一议二原则,作等温或等压辅助线)1、当压强不变时,升高温度,Y的体积分数变,平衡向方向移动,则正反应是热反应。2、当温度不变时,增大压强,Y的...