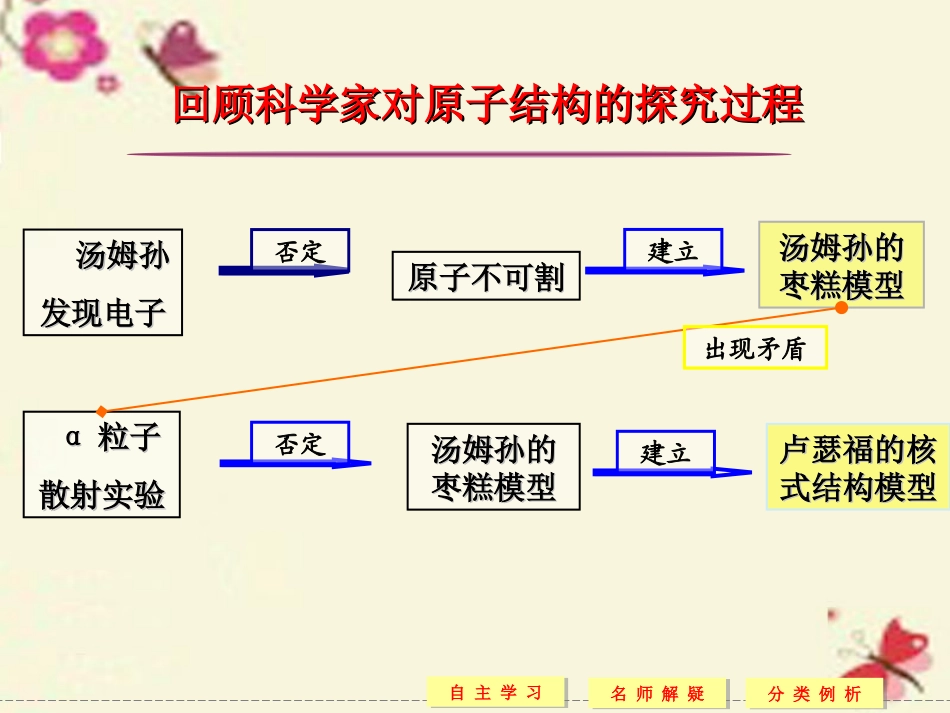
4玻尔的原子模型能级课堂设计教科版选修3-5第二章叙州区一中欧宏羽名师解疑名师解疑分类例析分类例析自主学习自主学习汤姆孙汤姆孙发现电子发现电子汤姆孙的汤姆孙的枣糕模型枣糕模型αα粒子粒子散射实验散射实验卢瑟福的核卢瑟福的核式结构模型式结构模型回顾科学家对原子结构的探究过程回顾科学家对原子结构的探究过程原子不可割原子不可割汤姆孙的汤姆孙的枣糕模型枣糕模型否定建立否定建立出现矛盾名师解疑名师解疑分类例析分类例析自主学习自主学习卢瑟福模型的困难卢瑟福模型的困难原子核式结构模型与经典电磁理论的矛盾核外电子绕核运动辐射电磁波电子轨道半径连续变小原子不稳定辐射电磁波频率连续变化事实上:原子是稳定的原子光谱是线状谱卢瑟福核式模型无法解释原子的稳定性和氢原子光谱的分立特征否定卢瑟福的核卢瑟福的核式结构模型式结构模型建立??1.了解玻尔原子理论的主要内容;2.了解能级、能量量子化概念;3.了解基态、激发态的概念;4.了解玻尔模型的局限性.一、玻尔理论的三条假设定态假设原子只能处于一系列不连续的状态中,在这些状态中原子是的.电子虽然绕核旋转,但并不向外能量,这些状态叫.能量稳定辐射定态能量假设原子从一种定态(能量为Em)到另一定态(能量为En)时,它辐射(或吸收)一定频率的,光子的能量由这两个定态的能量差决定,即.注意:电子如果从一个轨道到另一个轨道,是从一个轨道上“跳跃”到另一个轨道上,玻尔将这种现象称为跃迁.轨道假设原子的不同能量状态对应于电子不同的运行,原子的定态是的,因而电子的可能轨道也是的.轨道的半径(对于氢原子r1=0.53×10-10m).跃迁光子hν=Em-En轨道不连续不连续rn=n2r1二、能级能级:在玻尔模型中,原子的可能状态是不连续的,对应的能量也是不连续的,即原子的能量是的,这些量子化的能量值叫做.基态:能量最低的状态叫做.发态:除基态之外的其他能量状态叫做.氢原子的能级原子各能级的关系为En=E1n2(n=1,2,3……),氢原子的基态能量E1=eV,其他各激发态的能量为E2=eV,E3=eV…量子化能级基态激发态-13.6-3.4-1.51能级图氢原子的能级图如图2-4-1所示.图2-4-1注意:(1)原子的能量包括:原子的原子核与电子所具有的电势能和电子运动的动能.(2)原子从基态跃迁到激发态时要吸收能量,而从激发态跃迁到基态则以光子的形式向外放出能量.吸收或放出能量,这个能量值不是任意的,而是两个能级间的能量差.(3)n=1对应于基态,n→∞对应于原子的电离.三、玻尔模型的局限性局限性:成功地解释了氢原子光谱的实验规律,但不能解释稍微的原子的光谱现象.原因:保留了的观念,把电子的运动仍然看做描述下的运动.复杂一点经典粒子经典力学轨道一、玻尔的原子模型的主要物理思想轨道量子化:轨道半径只能够是一些不连续的、某些分立的数值.模型中保留了卢瑟福的核式结构,但他认为核外电子的轨道是不连续的,它们只能在某些可能的、分立的轨道上运动,而不是像行星或卫星那样,能量大小可以是任意的量值.例如,氢原子的电子最小轨道半径为r1=0.053nm,其余可能的轨道半径还有0.212nm、0.477nm…不可能出现介于这些轨道之间的其他值.跃迁:原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级Em发射光子hν=Em-En吸收光子hν=Em-En低能级En.可见,电子如果从一个轨道到另一个轨道,不是以螺旋线的形式改变半径大小的,而是从一个轨道上“跳跃”到另一个轨道上.玻尔将这种现象叫做电子的跃迁.二、氢原子的跃迁与电离及吸收与辐射能量问题跃迁:根据玻尔理论,当原子从低能态向高能态跃迁时,必须吸收光子才能实现.相反,当原子从高能态向低能态跃迁时,必须辐射光子才能实现,跃迁时不管是吸收还是辐射光子,其光子的能量都必须等于这两个能级的能量差.电离:原子一旦电离,原子结构被破坏,而不再遵守有关原子结构理论,如基态氢原子的电离能为13.6eV,只要能量大于或等于13.6eV的光子都能使基态的氢原子吸收而电离,只不过入射光子的能量越大,原子电离后产生的动能就越大,不论原子处于...