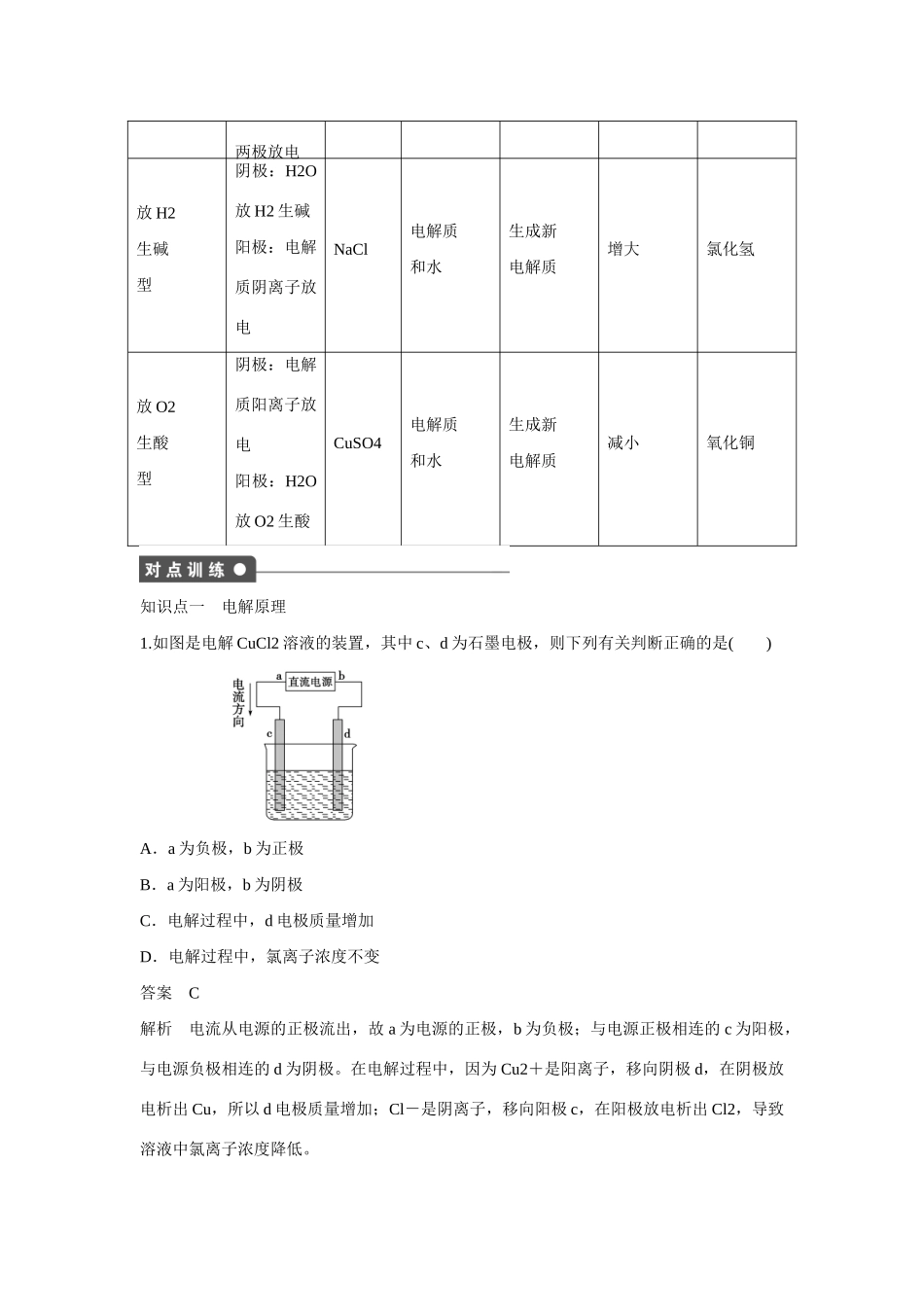
第2节——电能转化为化学能电解第1课时电解的原理[目标要求]1.了解电解池的工作原理。2.能写出电解池的电极反应式。一、电解概念及电解池的组成1.电解让直流电通过电解质溶液或熔融的电解质,在两电极上分别发生氧化反应和还原反应的过程叫电解。在日常生活中,人们常常需要通过电解使许多不能自发进行的反应顺利进行,电解过程中电能转化为化学能。人们把将电能转化为化学能的装置称为电解池。2.构成电解池的条件(1)两个相同或不同的电极;(2)外接直流电源;(3)电解质溶液或熔融的电解质。以上三部分形成闭合回路。二、电解的原理1.原理(1)电子从外接电源的负极流出,经导线到达电解池的阴极,电解质溶液中的阳离子移向阴极,氧化性强的离子在阴极获得电子而被还原,发生还原反应;与此同时,电解质溶液中的阴离子移向阳极,其中还原性强的离子在阳极上失去电子(也可能是阳极很活泼而本身失去电子)而被氧化,发生氧化反应,这样电子又从电解池的阳极流出,沿导线流回外接直流电源的正极。(2)电解池工作示意图(以电解CuCl2溶液为例)2.电极的判断及电极反应(1)阳极:与电源正极相连,溶液中阴离子移向此极,失去电子,发生氧化反应。(2)阴极:与电源负极相连,溶液中阳离子移向此极,得到电子,发生还原反应。三、离子的放电顺序及电解的规律1.放电阳离子得到电子而阴离子失去电子的过程叫放电。2.离子的放电顺序(1)阳极产物的判断首先看电极,如果是活泼电极(金属活动性顺序表中在Ag之前),则电极本身失电子被氧化,阴离子不放电;如果是惰性电极(Au、Pt、石墨),则要看溶液中阴离子失电子能力强弱,谁强谁放电,阴离子放电顺序为:S2->I->Br->Cl->OH->高价态含氧酸根>F-。(2)阴极产物的判断不用考虑电极本身,直接根据阳离子放电顺序进行判断,阳离子的放电顺序与金属活动性顺序相反,顺序为Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Ni2+>Fe2+>Zn2+>Mn2+>较活泼金属阳离子(注意Fe3+的顺序)。3.电解的规律类型电极反应特点实例电解对象电解质浓度pH值电解质溶液复原应加物质电解水型阴极:4H++4e-―→2H2↑阳极:4OH-―→2H2O+O2↑+4e-NaOH水增大增大水H2SO4水增大减小水Na2SO4水增大不变水电解电解质型电解质电离出的阴、阳离子分别在HCl电解质减小增大氯化氢CuCl2电解质减小增大氯化铜两极放电放H2生碱型阴极:H2O放H2生碱阳极:电解质阴离子放电NaCl电解质和水生成新电解质增大氯化氢放O2生酸型阴极:电解质阳离子放电阳极:H2O放O2生酸CuSO4电解质和水生成新电解质减小氧化铜知识点一电解原理1.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是()A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变答案C解析电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d为阴极。在电解过程中,因为Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,导致溶液中氯离子浓度降低。2.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的()a极板b极板X电极Z溶液A锌石墨负极CuSO4B石墨石墨负极NaOHC银铁正极AgNO3D铜石墨负极CuCl2答案A解析由题意知,通电后a极板质量增加,说明有金属析出,由此可知,a极为电解池的阴极,则X为电源负极,B、C均不符合;又b极放出的是无色无味的气体,可淘汰D。知识点二电解规律3.用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内的物质),能使溶液恢复到原来的成分和浓度的是()A.AgNO3[AgNO3]B.NaOH[H2O]C.KCl[KCl]D.CuSO4[Cu(OH)2]答案B解析A项:4AgNO3+2H2O=====4Ag+O2↑+4HNO3,脱离反应体系的物质是4Ag+O2,相当于2Ag2O,所以应当加入适量Ag2O才能复原(加入AgNO3,会使NO的量增加)B项:2H2O=====2H2↑+O2↑,脱离反应体系的是2H2+O2,相当于2H2O,加入适量水可以复原;C项:2KCl+2H2O=====2KOH+H2↑+Cl2↑,脱离反应体系的是H2...