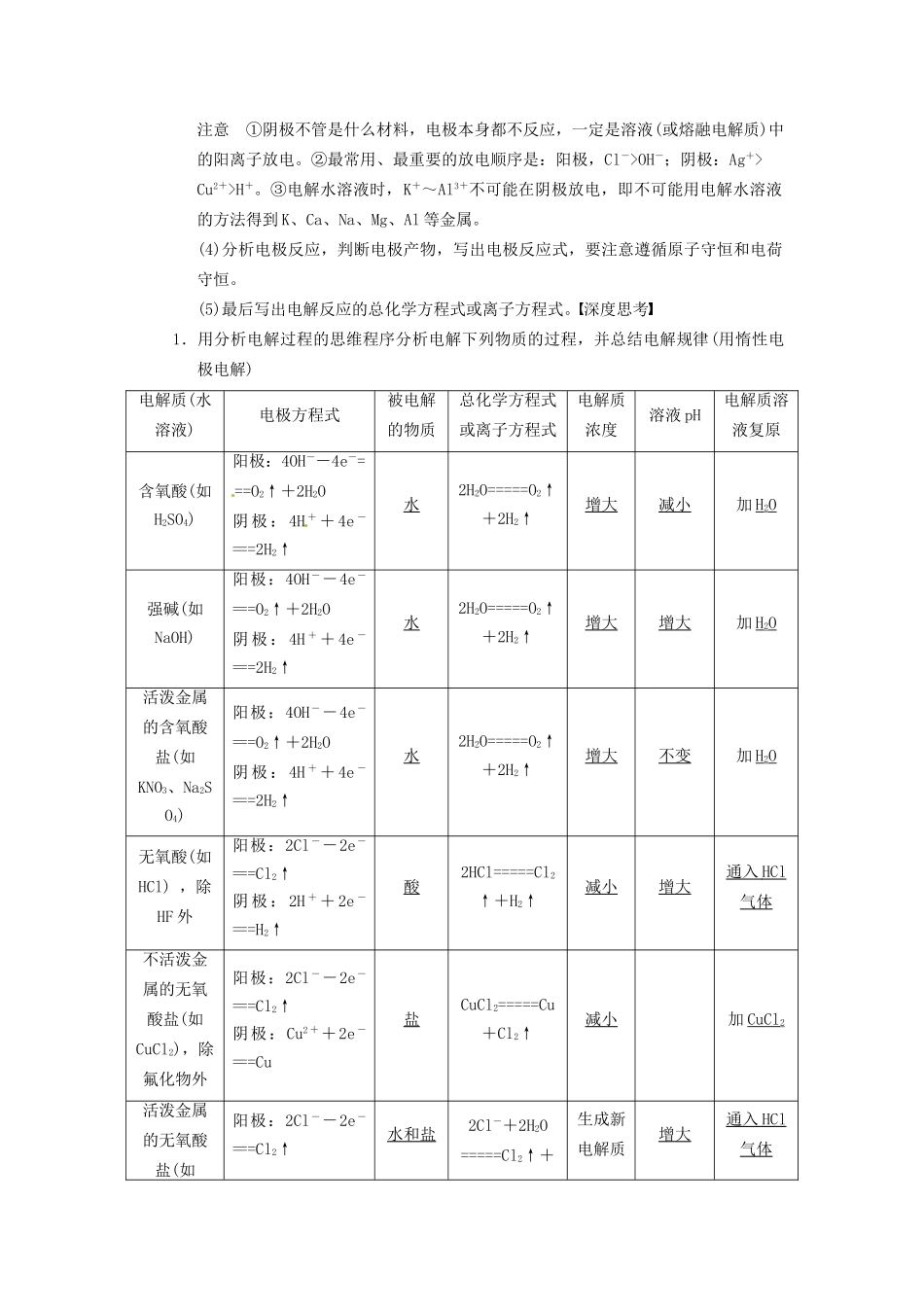
第3讲电解池金属的电化学腐蚀与防护[考纲要求]1.了解电解池的工作原理,能写出电极反应和电池反应方程式。2.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。考点一电解的原理1.电解定义在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。2.能量转化形式电能转化为化学能。3.电解池(1)构成条件①有与电源相连的两个电极。②电解质溶液(或熔融盐)。③形成闭合回路。(2)电极名称及电极反应式(如图)(3)电子和离子移动方向①电子:从电源负极流向电解池的阴极;从电解池的阳极流向电源的正极。②离子:阳离子移向电解池的阴极;阴离子移向电解池的阳极。4.分析电解过程的思维程序(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H+和OH-)。(3)然后排出阴、阳两极的放电顺序阴极:阳离子放电顺序:Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+。阳极:活泼电极>S2->I->Br->Cl->OH->含氧酸根离子。注意①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。②最常用、最重要的放电顺序是:阳极,Cl->OH-;阴极:Ag+>Cu2+>H+。③电解水溶液时,K+~Al3+不可能在阴极放电,即不可能用电解水溶液的方法得到K、Ca、Na、Mg、Al等金属。(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。(5)最后写出电解反应的总化学方程式或离子方程式。深度思考1.用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)电解质(水溶液)电极方程式被电解的物质总化学方程式或离子方程式电解质浓度溶液pH电解质溶液复原含氧酸(如H2SO4)阳极:4OH--4e-===O2↑+2H2O阴极:4H++4e-===2H2↑水2H2O=====O2↑+2H2↑增大减小加H2O强碱(如NaOH)阳极:4OH--4e-===O2↑+2H2O阴极:4H++4e-===2H2↑水2H2O=====O2↑+2H2↑增大增大加H2O活泼金属的含氧酸盐(如KNO3、Na2SO4)阳极:4OH--4e-===O2↑+2H2O阴极:4H++4e-===2H2↑水2H2O=====O2↑+2H2↑增大不变加H2O无氧酸(如HCl),除HF外阳极:2Cl--2e-===Cl2↑阴极:2H++2e-===H2↑酸2HCl=====Cl2↑+H2↑减小增大通入HCl气体不活泼金属的无氧酸盐(如CuCl2),除氟化物外阳极:2Cl--2e-===Cl2↑阴极:Cu2++2e-===Cu盐CuCl2=====Cu+Cl2↑减小加CuCl2活泼金属的无氧酸盐(如阳极:2Cl--2e-===Cl2↑水和盐2Cl-+2H2O=====Cl2↑+生成新电解质增大通入HCl气体NaCl)阴极:2H++2e-===H2↑H2↑+2OH-不活泼金属的含氧酸盐(如CuSO4)阳极:4OH--4e-===O2↑+2H2O阴极:2Cu2++4e-===2Cu水和盐2Cu2++2H2O=====2Cu+O2↑+4H+生成新电解质减小加CuO或CuCO32.电解过程中放H2生碱型和放O2生酸型的实质是什么?答案放H2生碱型的实质是水电离出的H+放电,破坏了水的电离平衡,使OH-浓度增大,放O2生酸型的实质是水电离出的OH-放电,破坏了水的电离平衡,使H+浓度增大。3.(1)上表中要使电解后的NaCl溶液复原,滴加盐酸可以吗?(2)上表中要使电解后的CuSO4溶液复原,加入Cu(OH)2固体可以吗?“”答案电解质溶液的复原应遵循从溶液中析出什么补什么的原则,即从溶液中析出哪种元素的原子,则应按比例补入哪些原子。(1)电解NaCl溶液时析出的是等物质的量的Cl2和H2,所以应通入氯化氢气体,加入盐酸会引入过多的水。(2)同理,使CuSO4溶液复原应加入CuO,而加入Cu(OH)2也会使溶液的浓度降低。4“.在框图推断中若出现A+H2O=====B+C+D”的模式,则A一般可能为什么物质?答案CuSO4、NaCl(KCl)或AgNO3,要视其他条件而定。题组一电解原理和电解规律的考查1.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是()A.CuSO4B.NaOHC.BaCl2D.H2SO4答案A解析符合该题条件的电解质应为不活泼金属的含氧酸盐。2.用铂电极电解一定浓度的下列物质的水溶液,在电解后的电解液中加适量水,能使溶液浓度恢复到电解前浓度的是()A.NaClB.Na2CO3C.CuSO4D....