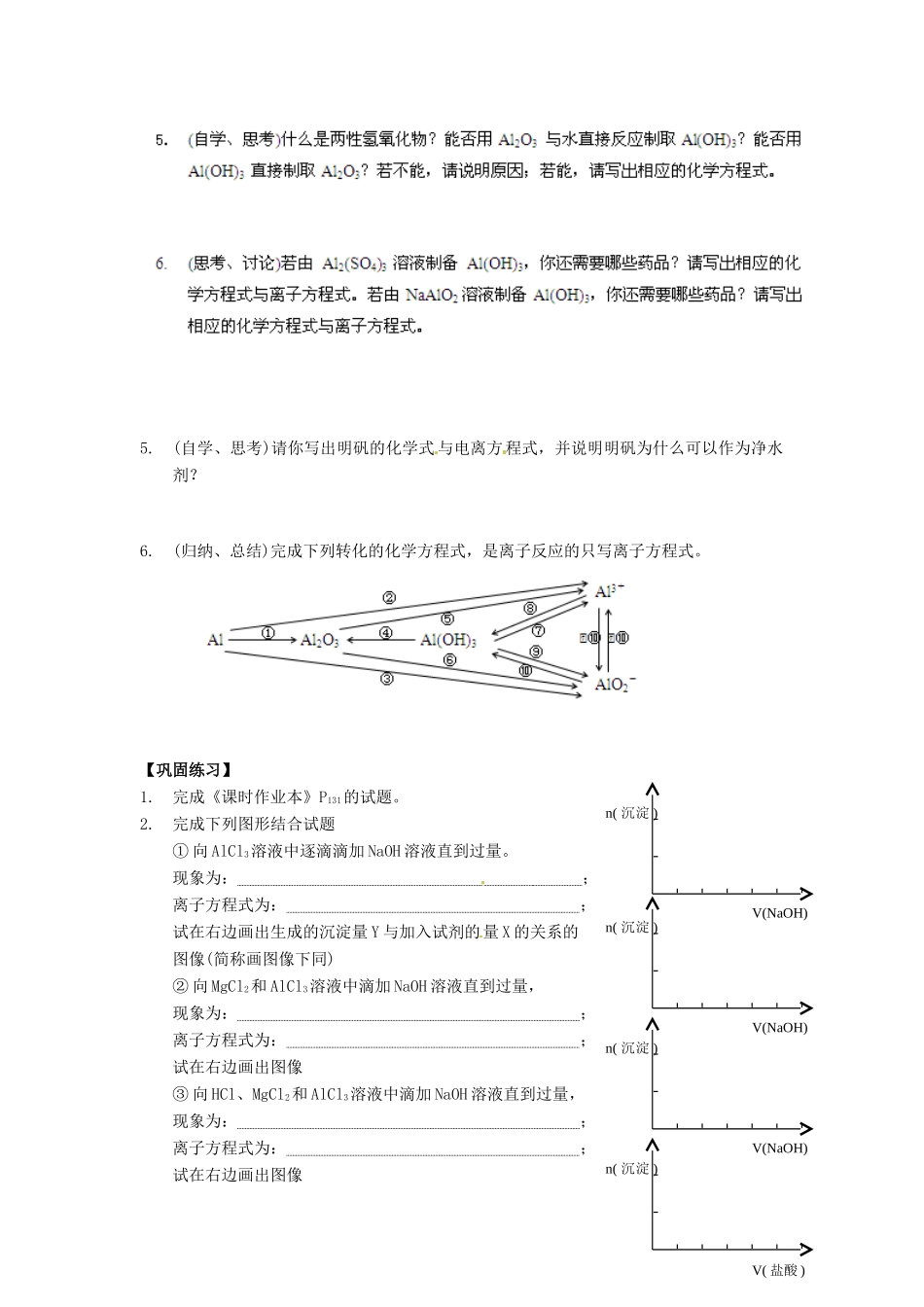
【新编精品】人教化学必修一3.2《几种重要的金属化合物》导学案(第2课时)【学习目标】1.知道氧化铝与氢氧化铝的性质;2.掌握两性氧化物与两性氢氧化物的概念;3.掌握氢氧化铝的制备方法;4.知道明矾的净水原理。1.(思考、讨论)什么是两性氧化物?请分别写出氧化铝与盐酸、氢氧化钠溶液反应的化学方程式和离子方程式。2.(观察、思考)在试管里加入10mL0.5mol/LAl2(SO4)3溶液,逐滴滴加氨水至过量,有何现象产生?写出相关的化学方程式和离子方程式。3.(观察、思考)在试管里加入10mL1mol/LAlCl3溶液,逐滴滴加2mol/L氢氧化钠溶液至过量,有何现象产生?写出相关的化学方程式和离子方程式。4.(观察、思考)向第4题最终反应后的试管内,逐滴滴加2mol/L盐酸至过量,有何现象产生?写出相关的化学方程式和离子方程式。5.(自学、思考)请你写出明矾的化学式与电离方程式,并说明明矾为什么可以作为净水剂?6.(归纳、总结)完成下列转化的化学方程式,是离子反应的只写离子方程式。【巩固练习】1.完成《课时作业本》P131的试题。2.完成下列图形结合试题①向AlCl3溶液中逐滴滴加NaOH溶液直到过量。现象为:;离子方程式为:;试在右边画出生成的沉淀量Y与加入试剂的量X的关系的图像(简称画图像下同)②向MgCl2和AlCl3溶液中滴加NaOH溶液直到过量,现象为:;离子方程式为:;试在右边画出图像③向HCl、MgCl2和AlCl3溶液中滴加NaOH溶液直到过量,现象为:;离子方程式为:;试在右边画出图像n(沉淀)V(NaOH)n(沉淀)V(NaOH)n(沉淀)V(NaOH)n(沉淀)V(盐酸)④向NaAlO2溶液中滴加盐酸直到过量,现象为:;离子方程式为:;试在右边画出图像⑤向NaOH和NaAlO2溶液中滴加盐酸直到过量,现象为:;离子方程式为:;试在右边画出图像3.某校化学兴趣小组用如图所示过程除去AlCl3溶液中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:⑴写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:⑵氢氧化钠溶液能否用氨水代替,为什么?⑶溶液a中存在的离子有哪些?在溶液a中加入盐酸时需控制溶液的pH,为什么?应如何改进?在100mL1mol·L-1AlCl3溶液中滴加1mol·L-1NaOH溶液,得到3.9g沉淀,则加入的NaOH溶液的体积可能是A.150mLB.200mLC.300mLD.350mL4.将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中铝元素与溶液中铝元素的质量相等,则氯化铝溶液和氢氧化钠溶液的物质的量浓度之比为A.1∶3B.2∶3C.1∶4D.2∶75.有镁、铝混合粉末10.2g,将它溶于1000mL、2mol/L的盐酸中,若要使沉淀质量达到最大值,则需加入金属钠的质量为A.46gB.23gC.4.6gD.69g6.用稀硫酸,氢氧化钠,铝为原料制取Al(OH)3可通过不同的途径甲:Al→Al2(SO4)3→Al(OH)3乙:Al→NaAlO2→Al(OH)3丙:}→Al(OH)3若要制得等量的Al(OH)3则A.乙消耗的原料最少B.三者消耗的原料相同C.丙消耗的原料最少D.甲乙消耗的原料相同7.在100mLbmol/LAlCl3溶液中加入100mLamol/LNaOH溶液。①当a≤3b时,生成Al(OH)3的物质的量为mol;②当a、b满足条件时,无沉淀生成;③当a、b满足条件时,a增大,沉淀量减少,此时生成沉淀g。n(沉淀)V(盐酸)