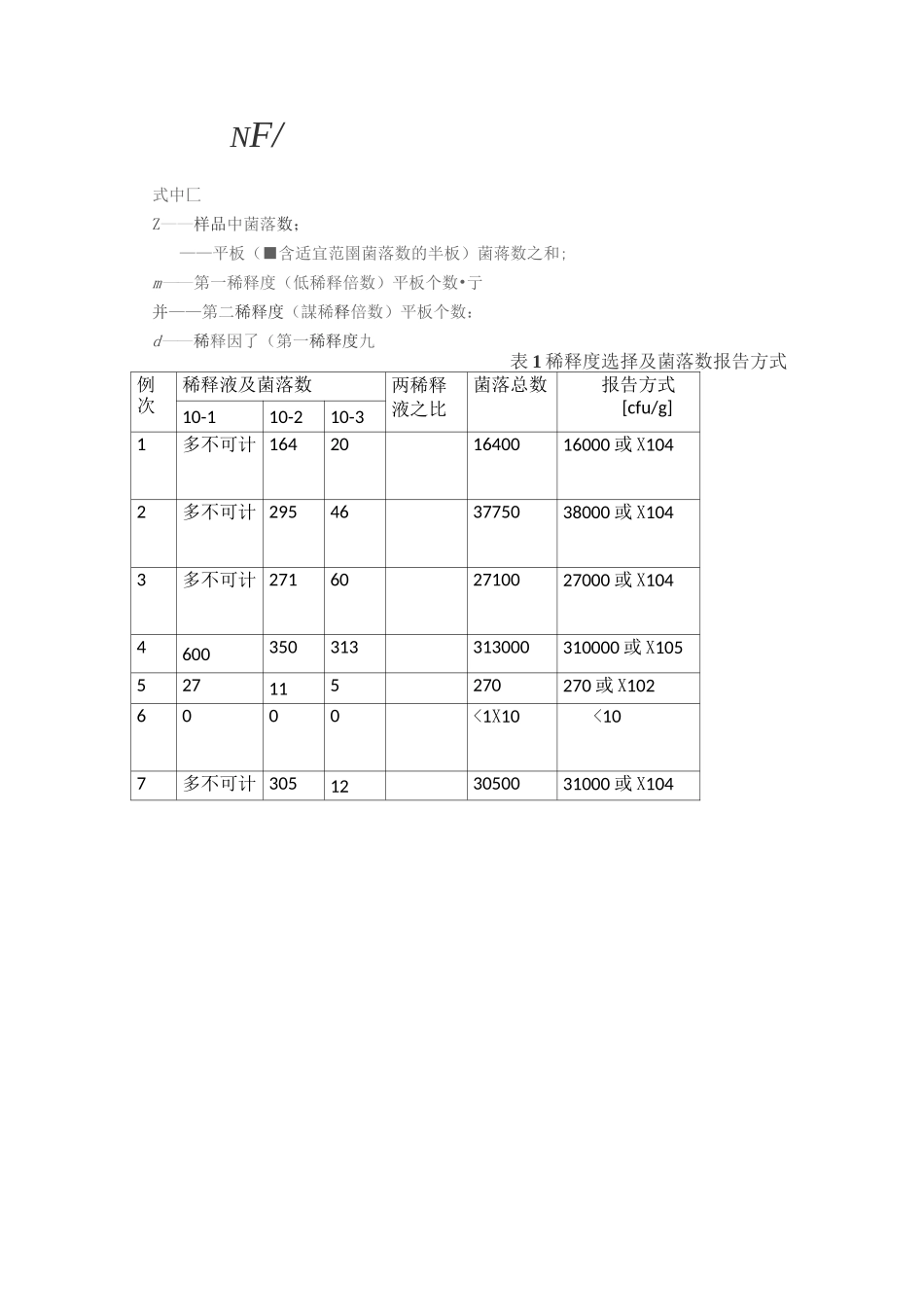
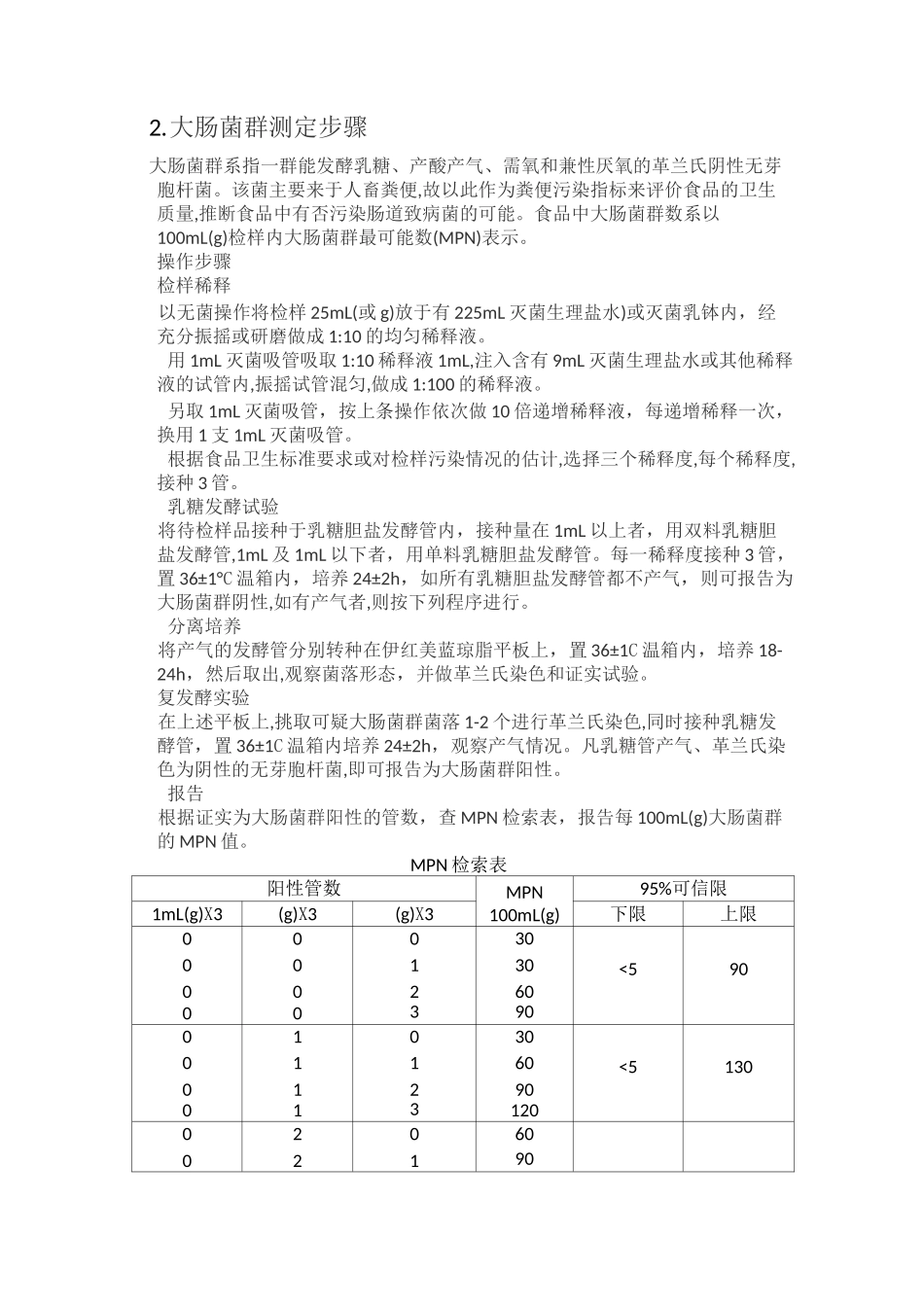
1.菌落总数操作步骤检样稀释及培养以无菌操作,取样25g放入225mL灭菌生理盐水或灭菌乳钵中,经充分振摇作成1:10均匀稀释液。用1mL灭菌吸管吸取1:10稀释液1mL,沿管壁徐徐注入含有9mL灭菌生理盐水或其他稀释液的试管内(注意吸管尖端不要触及管内稀释液),振摇试管,混合均匀,做成1:100的稀释液。另取1mL灭菌吸管,按上条操作顺序,做10倍递增稀释液,如此每递增稀释一次,即换用1支1mL火菌吸管。根据食品卫生标准要求或对标本污染情况的估计,选择2〜3个适宜稀释度,分别在做10倍递增稀释的同时,即以吸取该稀释度的吸管移1mL稀释液于灭菌平皿内,每个稀释度做两个平皿。稀释液移入平皿后,应及时将凉至45°C营养琼脂培养基,注入平皿约15mL,并转动平皿使混合均匀。同时将营养琼脂培养基倾入加有1mL稀释液的灭菌平皿内作空白对照待琼脂凝固后,翻转平板(使平皿底朝上),置36±1C温箱内培养48±2h。菌落计数方法做平板菌落计数时,可用肉眼观查,必要时用放大镜检查,以防遗漏。在记下各平板的菌落数后,求出同稀释度的各平板平均菌落总数。菌落计数的报告平板菌落数的选择选取菌落数在30〜300之间的平板作为菌落总数测定标准。一个稀释度使用两个平板,应采用两个平板平均数,其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释度的菌落数,若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘2以代表全皿菌落数。稀释度的选择应选择平均菌落数在30〜300之间的稀释度,乘以稀释倍数报告之(见表1中例1)。若有两个稀释度,其生长的菌落数均在30〜300之间,则视两者之比如何来决定。若其比值小于或等于2,应报告其平均数;若大于2则报告其中较小的数字(见表中例2及3)。若所有稀释度的平均菌落数均大于300,则应按稀释度最高的平均菌落数乘以稀释倍数报告之(见表1中例4)。若所有稀释度的平均菌落数均小于30,则应按稀释度最低的平均菌落数乘以稀释倍数报告之(见表1中例5)。若所有稀释度均无菌落生长,则以小于1乘以最低稀释倍数报告之(见表1中例6)。若所有稀释度的平均菌落数均不在30〜300之间,其中一部分大于300或小于30时,则以最接近30或300的平均菌落数乘以稀释倍数报告之。若只有一个稀释度菌落在适宜计数范围内,计算平均值X稀释倍数;作为结果;若两个连续稀释度的菌落都在适宜计数范围内时按公式计算:NF/式中匚Z——样品中菌落数;——平板(■含适宜范圉菌落数的半板)菌蒋数之和;m——第一稀释度(低稀释倍数)平板个数•亍并——第二稀释度(謀稀释倍数)平板个数:d——稀释因了(第一稀释度九表1稀释度选择及菌落数报告方式例次稀释液及菌落数两稀释液之比菌落总数报告方式[cfu/g]10-110-210-31多不可计164201640016000或X1042多不可计295463775038000或X1043多不可计271602710027000或X1044600350313313000310000或X105527115270270或X1026000<1X10<107多不可计305123050031000或X1042.大肠菌群测定步骤大肠菌群系指一群能发酵乳糖、产酸产气、需氧和兼性厌氧的革兰氏阴性无芽胞杆菌。该菌主要来于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,推断食品中有否污染肠道致病菌的可能。食品中大肠菌群数系以100mL(g)检样内大肠菌群最可能数(MPN)表示。操作步骤检样稀释以无菌操作将检样25mL(或g)放于有225mL灭菌生理盐水)或灭菌乳钵内,经充分振摇或研磨做成1:10的均匀稀释液。用1mL灭菌吸管吸取1:10稀释液1mL,注入含有9mL灭菌生理盐水或其他稀释液的试管内,振摇试管混匀,做成1:100的稀释液。另取1mL灭菌吸管,按上条操作依次做10倍递增稀释液,每递增稀释一次,换用1支1mL灭菌吸管。根据食品卫生标准要求或对检样污染情况的估计,选择三个稀释度,每个稀释度,接种3管。乳糖发酵试验将待检样品接种于乳糖胆盐发酵管内,接种量在1mL以上者,用双料乳糖胆盐发酵管,1mL及1mL以下者,用单料乳糖胆盐发酵管。每一稀释度接种3管,置36±1°C温箱内,培养24±2h,如所有乳糖胆盐发酵管都不产气,则可报告为大肠菌群阴性,如有产气者,则按下列程序进行。分离培养将产气的发酵管分别转种在伊...