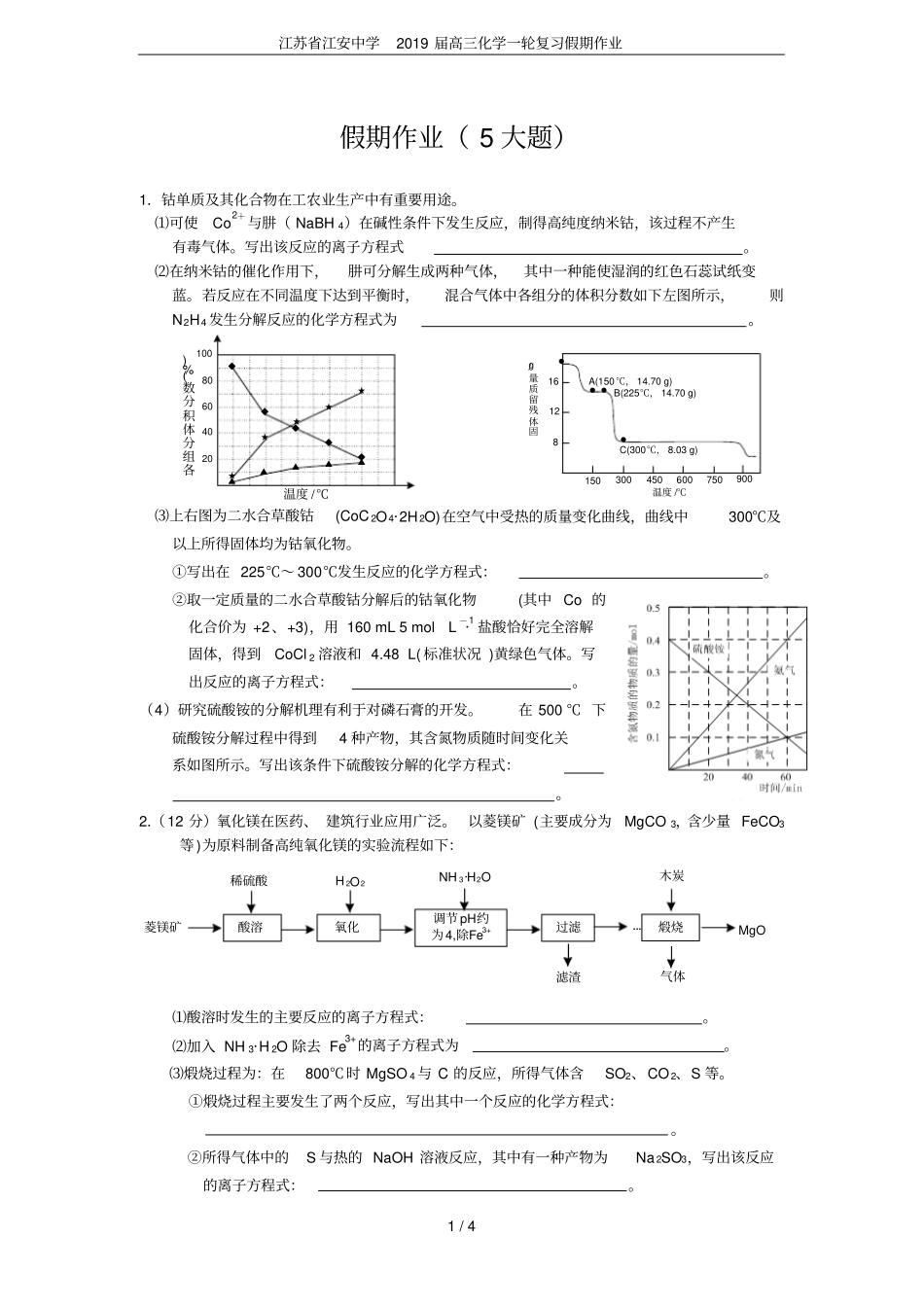
江苏省江安中学2019届高三化学一轮复习假期作业1/4假期作业(5大题)1.钴单质及其化合物在工农业生产中有重要用途。⑴可使Co2+与肼(NaBH4)在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。写出该反应的离子方程式。⑵在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下左图所示,则N2H4发生分解反应的化学方程式为。40206080100温度/℃各组分体积分数(%)◆◆◆◆★▲★★★▲▲▲★◆▲●●●●固体残留质量/g75081216温度/℃150300450600900A(150℃,14.70g)B(225℃,14.70g)C(300℃,8.03g)⑶上右图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。①写出在225℃~300℃发生反应的化学方程式:。②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用160mL5mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。写出反应的离子方程式:。(4)研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图所示。写出该条件下硫酸铵分解的化学方程式:。2.(12分)氧化镁在医药、建筑行业应用广泛。以菱镁矿(主要成分为MgCO3,含少量FeCO3等)为原料制备高纯氧化镁的实验流程如下:酸溶氧化调节pH约为4,除Fe3+过滤煅烧菱镁矿稀硫酸H2O2NH3·H2O滤渣气体木炭MgO···⑴酸溶时发生的主要反应的离子方程式:。⑵加入NH3·H2O除去Fe3+的离子方程式为。⑶煅烧过程为:在800℃时MgSO4与C的反应,所得气体含SO2、CO2、S等。①煅烧过程主要发生了两个反应,写出其中一个反应的化学方程式:。②所得气体中的S与热的NaOH溶液反应,其中有一种产物为Na2SO3,写出该反应的离子方程式:。江苏省江安中学2019届高三化学一轮复习假期作业2/43.天然紫草素类化合物及其衍生物具有不同程度的细胞毒作用和抗肿瘤作用。现有一种合成紫草素类化合物(G)的合成路线如下:NOHOH(CH3)2SO4K2CO3OCH3OCH3O==OBrOCH3OCH3BrCH3OHCH3ONaBrOCH3OCH3CH3OPOCl3,CHCl3二甲基甲酰胺CH3OOCH3OCH3CH3OCH3OCHO①CH3(CH2)3CH2MgBr②H+/H2OOCH3OCH3CH3OCH3OOHCH3COOHOCH3OCH3CH3OCH3OOOCCH3ABCDEFG已知:CH3(CH2)3CH2Br----------→Mg四氢呋喃,回流CH3(CH2)3CH2MgBr请回答下列问题:⑴在空气中久置后,A会由白色转变为橙黄色,其原因是____________________。⑵FG的反应类型是_________,E中的含氧官能团有_____和_____(填写名称)。⑶写出AB的化学反应方程式_________________________________________。⑷写出同时符合下列条件的D的一种同分异构体的结构简式__________(任写一种)。①分子中含有一个萘环;②与FeCl3溶液能发生显色反应;③该分子核磁共振氢谱有2种不同的峰,峰值比为1∶3。⑸有关物质F的说法中,正确的有A.1molF的分子中含有5mol双键B.每个F分子中含有一个手性碳原子C.F既能发生酯化反应,也能发生消去、催化氧化等反应D.F既能与氢溴酸反应,也能与氢氧化钠溶液反应4.下列各小题所涉及的反应均为氧化还原反应,根据电子守恒原理加以解答可以使计算过程大大简化。⑴纺织工业中常用氯气作漂白剂,漂白后布匹需要“脱氯”。NaHSO3与Na2S2O3均可用于脱氯,它们与氯气发生反应的产物中均含SO2-4、Cl-。处理等量的含氯废水,所需NaHSO3与Na2S2O3的物质的量之比为。⑵某糕点包装中的脱氧保鲜剂(如图所示)的组成为铁粉、氯化钠、炭粉,其脱氧原理与钢铁的吸氧腐蚀相同,铁最终转化为氧化铁。若糕点包装袋中含有33.6mL(标准状况)氧气,则脱氧剂中至少应含g的铁粉,才能确保袋中的空气被完全吸收。⑶测定一种含氧化亚铜(Cu2O)的矿石中氧化亚铜含量的方法是:取4.0g矿样溶于含H2SO4的Fe2(SO4)3溶液中,发生如下化学反应:Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O此时生成的FeSO4可用酸性KMnO4溶液滴定(还原产物为MnSO4),消耗0.1mol·L-1酸性KMnO4溶液40.0mL。矿样中氧化亚铜的质量分数为。江苏省江安中学2019届高三化学一轮...