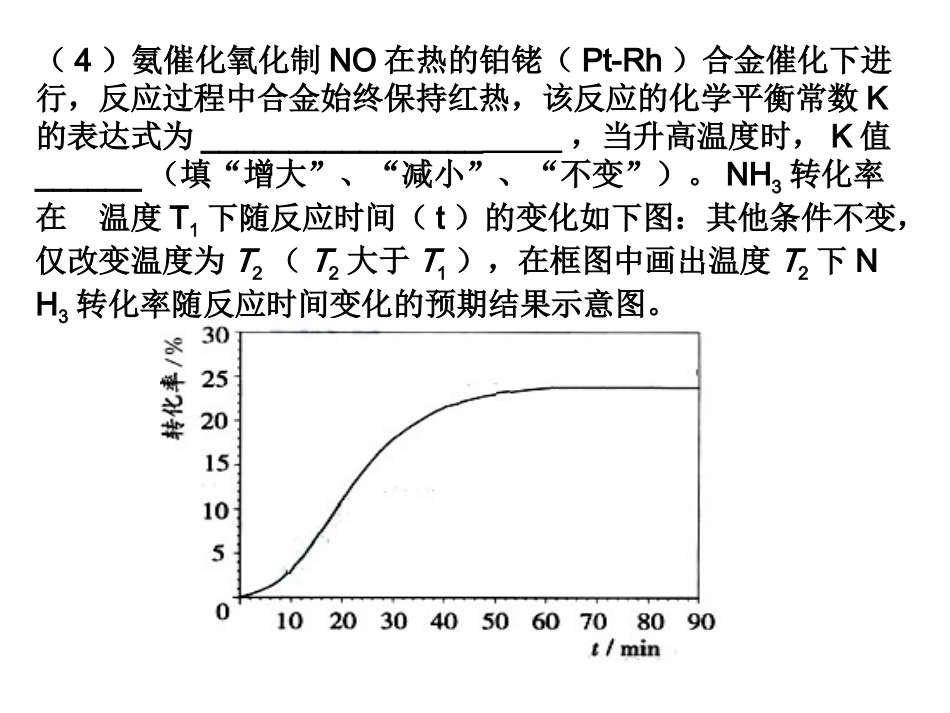
1.已知:N2(g)+3H2(g)2NH3(g)ΔH=-92.4kJ·mol-1。(1)在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3molH2,10min时达到平衡,有0.2molNH3生成,则10min内用氢气表示的该反应的平均速率v(H2)为,H2的转化率为__________。(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是。(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________A.降低温度B.不断补充氮气C.恒容下充入He来增大压强D.升高温度E.原料气不断循环F.及时移出氨(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如下图:其他条件不变,仅改变温度为T2(T2大于T1),在框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。2:超音速飞机在平流层飞行时,尾气中的会破坏臭氧层。科学家正在研究利用催化技术将尾气中的和转变成和,化学方程式如下:为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:(1)在上述条件下反应能够自发进行,则反应的0(填写“>”、“<”、“=”。(2)前2s内的平均反应速率v(N2)=_____________。(3)在该温度下,反应的平衡常数K=。(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是。A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积C(NO)(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。①请在上表格中填入剩余的实验条件数据。②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。:(珠海摸拟)工业上用CO生产燃料甲醇。-1()Ⅰ表示反应中能量的变化;图3-16-1()Ⅱ表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。()Ⅰ()Ⅱ一定条件下发生反应:CO(g)+2H2(g)CH3OH(g)。图3-16请回答下列问题:(1)在图()Ⅰ中,曲线____(填“a”或“b”)表示使用了催化剂;该反应属于________(填“吸热”或“放热”)反应。(2)下列说法正确的是________(填字母)。A.起始充入的CO为2molB.增大CO的浓度,CO的转化率增大C.容器中压强恒定时,反应已达平衡状态D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小(3)从反应开始到建立平衡,v(H2)=________;CO的转化率数为____________。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数__________(填“增大”、“减小”或“不变”)。________;该温度下CO(g)+2H2(g)CH3OH(g)的化学平衡常(4)请在图()Ⅲ中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的两条曲线(在曲线上标出p1、p2,且p1
”或“<”)。实际生产条件控制在左右,选择此压强的理由是。