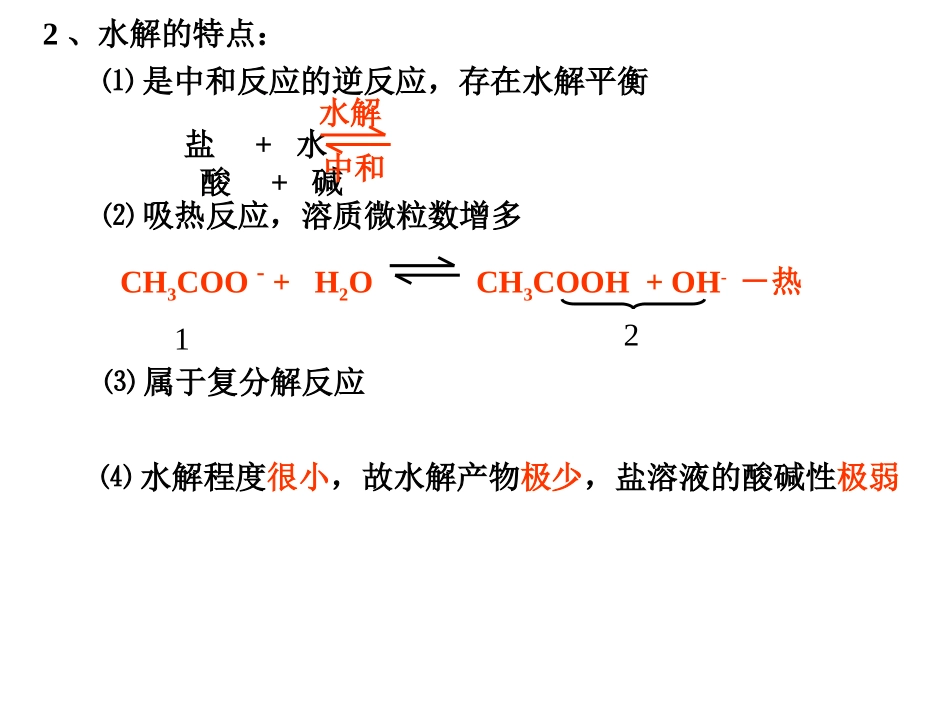
§3-1盐类水解一、盐类水解1、定义盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。小结:有弱必水解,无弱不水解;弱弱双水解,越弱越水解;越稀越水解,越高越水解;强者定性!⑴含弱酸阴离子的盐:CH3COO-CO32-F-S2-PO43-等⑵含弱碱阳离子的盐:NH4+Al3+Cu2+Fe3+Ag+等水解的结果:促进了水的电离,使溶液呈酸碱性2、水解的特点:⑴是中和反应的逆反应,存在水解平衡⑵吸热反应,溶质微粒数增多⑶属于复分解反应⑷水解程度很小,故水解产物极少,盐溶液的酸碱性极弱盐+水酸+碱水解中和CH3COO-+H2OCH3COOH+OH--热123、水解反应的方程式书写1、一般用“”2、一般不用“↑、↓”3、多元弱酸根离子的水解分步写,一般只写第一步4、多元弱碱阳离子的水解一步到位6、多元弱酸的酸式酸根离子水解与电离共存例、书写下列物质水解的化学方程式和离子方程式CuCl2、NaF、NH4Cl、Na2CO3Mg3N2、Al2S35、双水解进行到底的,用“↑、↓”,均一步到位4、水解平衡的影响因素(一)内因:盐的本性(越弱越水解)对应的酸越弱酸越难电离水解后OH-浓度大PH值大酸根离子与H+的结合能力越强碱性强①、不同弱酸对应的盐NaClONaHCO3MgCl2AlCl3对应的酸HClOH2CO3<>碱性②、不同弱碱对应的盐对应的碱酸性>Mg(OH)2Al(OH)3<③、同一弱酸对应的盐Na2CO3NaHCO3对应的酸HCO3-H2CO3<>碱性∴正盐的水解程度酸式盐的水解程度>④、多元弱酸对应的酸式盐:一般来说,水解趋势大于电离趋势(NaH2PO4和NaHSO3例外)Na3PO4Na2HPO4NaH2PO4H3PO4Na2SO3Na2SO4NaHSO3NaHSO4PH值>>>>>>⑤、弱酸弱碱盐:水解程度较大(能生成沉淀或气体的双水解可以进行到底)(二)外因:压强与催化剂对水解平衡无影响CH3COO-+H2OCH3COOH+OH--热12水解反应的特点:①吸热②溶质微粒数增多(与电离过程相同)①、温度:升温促进水解,降温抑制水解CH3COONa的酚酞溶液加热后颜色:加深②、浓度:Al3++3H2OAl(OH)3+3H+-热-14加水稀释,促进水解,[H+]减小加AlCl3固体,促进水解,[H+]增大二、盐类水解的应用(定性)(一)、某些盐溶液的配制与保存FeCl3:加少量稀盐酸FeCl2:加少量稀盐酸和铁屑NH4F溶液:铅容器或塑料瓶:加相应的酸或碱(二)、某些物质的用途(1)用盐作净化剂:明矾、FeCl3等Al3++3H2OAl(OH)3(胶体)+3H+Fe3++3H2OFe(OH)3(胶体)+3H+胶体可以吸附不溶性杂质+6的铁具有强氧化性,其还原产物水解生成Fe(OH)3胶体具有吸附性。Cl2+2Fe2+2Fe3++2Cl-Cl2+H2OH++Cl-+HClO(2)用盐作杀菌剂:Na2FeO4、氯气和绿矾混合等(3)用盐作洗涤剂:Na2CO3、C17H35COONa等CO32-+H2OHCO3-+OH-C17H35COO-+H2OC17H35COOH+OH-加热,平衡左移,碱性增强,去污效果好(4)肥料的混用Ca(H2PO4)2NH4+K2CO3(酸性)(酸性)(碱性)NH3↑Ca3(PO4)2↓(5)Na2SiO3和NH4Cl混合:加速凝结SiO32-+2NH4++2H2OH2SiO3↓+2NH3·H2O(6)Al2(SO4)3和NaHCO3溶液反应:用于泡沫灭火器2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑速度快、耗盐少玻璃筒铁筒NaHCO3Al2(SO4)3(三)、判断溶液的酸碱性(相同温度、浓度下)NaHCO3Na2CO3NaClOCH3COONH4Na2SO4Na2HPO4NaH2PO4NaHSO3NaHSO4AgNO3(四)、某些盐的无水物,不能用蒸发溶液或灼烧晶体的方法制取AlCl3溶液蒸干Al(OH)3灼烧Al2O3MgCl2·6H2OMg(OH)2MgO△△晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2FeCl3溶液Fe(NO3)3溶液Fe2(SO4)3溶液Na2CO3·10H2ONa2CO3溶液Na2SO3溶液Ca(HCO3)2溶液Fe2O3Fe2O3Fe2(SO4)3Na2CO3Na2CO3Na2SO4CaCO3(五)、溶液中微粒浓度以CH3COONa为例:1、一个不等式(除水外)[Na+]>[CH3COO-]>>[OH-]>[CH3COOH]>>[H+]2、三个守恒(1)物料守恒:是指某一成份的原始浓度应该等于该成份在溶液中各种存在形式的浓度之和。在晶体中[Na+][CH3COO-]在溶液中[Na+]=[CH3COO-]+[CH3COOH][Na+]+[H+]=[CH3COO-]+[OH-](2)电荷守恒:是指溶液中所有阳离子所带的正电荷数等于溶液中所有阴离子所带的负电荷数。整个溶液呈电中性。注意:电中性:不是[H+]=[OH-],而是正电荷数=负电荷数[CO32-]和2[CO32-]不同:离子浓度、电荷浓度。(3)水电离的OH-与H+守恒[Na+]=[CH3COO-]+[CH3...