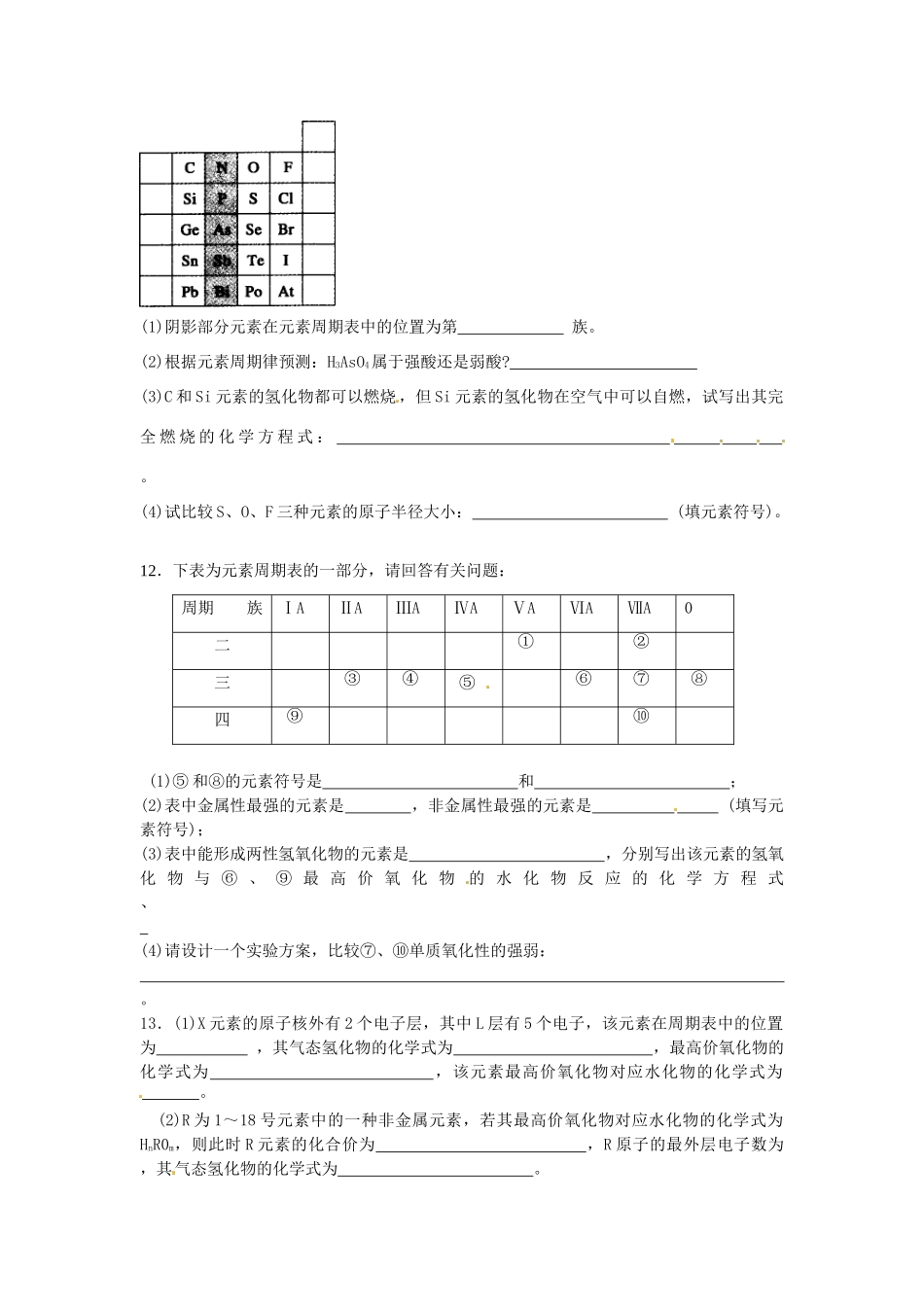
江西省宜春市宜春中学高中化学1.2元素周期表和元素周期律的应用学案新人教版必修21.X元素最高价氧化物对应的水化物为HX03,它的气态氢化物为()A.HXB.H2XC.XH3D.XH42.下列各组元素中,按最高正价递增的顺序排列的是()A.C,N,O,FB.K、Mg,Si,SC.F、Cl、Br、ID.Li、Na、K、Rb3.下列说法正确的是()A.在元素周期表中金属与非金属分界线左边的元素均为金属元素B.Na、Mg、Al的还原性依次减弱C.F、Cl、Br的非金属性依次增强D.NaOH、KOH、Mg(OH)2的碱性依次减弱4.下列关于元素周期律和元素周期表的论述中正确的是()A.同一主族的元素从上到下金属性逐渐减弱B.元素周期表是元素周期律的具体表现形式C.同一周期从左到右,元素原子半径逐渐增大D.非金属元素的最高正化合价等于它的负化合价的绝对值5.砷(As)为第四周期第VA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是()A.砷在通常情况是固体B.可以存在-3、+3、+5等多种化合价C.AsH3的稳定性比PH3弱D.单质砷的还原性比单质磷弱6.短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是()A.a是一种活泼的非金属元素B.c的最高价氧化物的水化物是一种弱酸C.b的氢化物很稳定D.b元素的最高化合物为+7价7.X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是()A.原子半径:W>Z>Y>XB.最高价氧化物对应水化物的酸性W比Z弱C.Y的气态氢化物的稳定性较Z的弱D.四种元素的单质中,Z的熔、沸点最高8.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是()A.若X(OH)n为强碱,则Y(OH)n也一定为强碱B.若HnX0m为强酸,则X的氢化物溶于水一定显酸性C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2D.若Y的最高正价为+m,则X的最高正价一定为+m9.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第六周期,Tl3+与Ag在酸性环境中发生反应:Tl3++2Ag=Tl++2Ag+。下列推断正确的是()A、Tl+的最外层有一个电子B、Tl3+的氧化性比Al3+弱C、Tl能形成+3价和+1价化合物D、Tl3+的还原性比Ag强题号123456789答案10.用“>”或“<”回答下列问题:(1)酸性:H2CO3____H2SiO3,H2SiO3____H3PO4(2)碱性:Ca(OH)2___Mg(OH)2,Mg(OH)2____Al(OH)3(3)气态氢化物稳定性:H2O____H2S,H2S____HCl(4)还原性:H2O____H2S,H2S____HCl(5)酸性:H2SO4____H2SO3,HClO4____HClO从以上答案中可以归纳出:①元素的非金属性越强,其对应的最高价氧化物的酸性越。②元素的金属性越强,其对应最高价氧化物对应水化物的碱性越。③元素性越强,其对应气态氢化物的稳定性越。④元素非金属性越强,其气态氢化物的还原性越。⑤同种非金属元素形成的含氧酸,成酸元素价态越高,其酸性也越。11.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分。(1)阴影部分元素在元素周期表中的位置为第族。(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,试写出其完全燃烧的化学方程式:。(4)试比较S、O、F三种元素的原子半径大小:(填元素符号)。12.下表为元素周期表的一部分,请回答有关问题:周期族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0二①②三③④⑤⑥⑦⑧四⑨⑩(1)⑤和⑧的元素符号是和;(2)表中金属性最强的元素是,非金属性最强的元素是(填写元素符号);(3)表中能形成两性氢氧化物的元素是,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式、(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:。13.(1)X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置为,其气态氢化物的化学式为,最高价氧化物的化学式为,该元素最高价氧化物对应水化物的化学式为。(2)R为1~18号元素中的一种非金属元素,若其最高价氧化物对应水化物的化学式为HnR0m,则此时R元素的化合价为,R原子的最外层电子数为,其气态氢化物的...