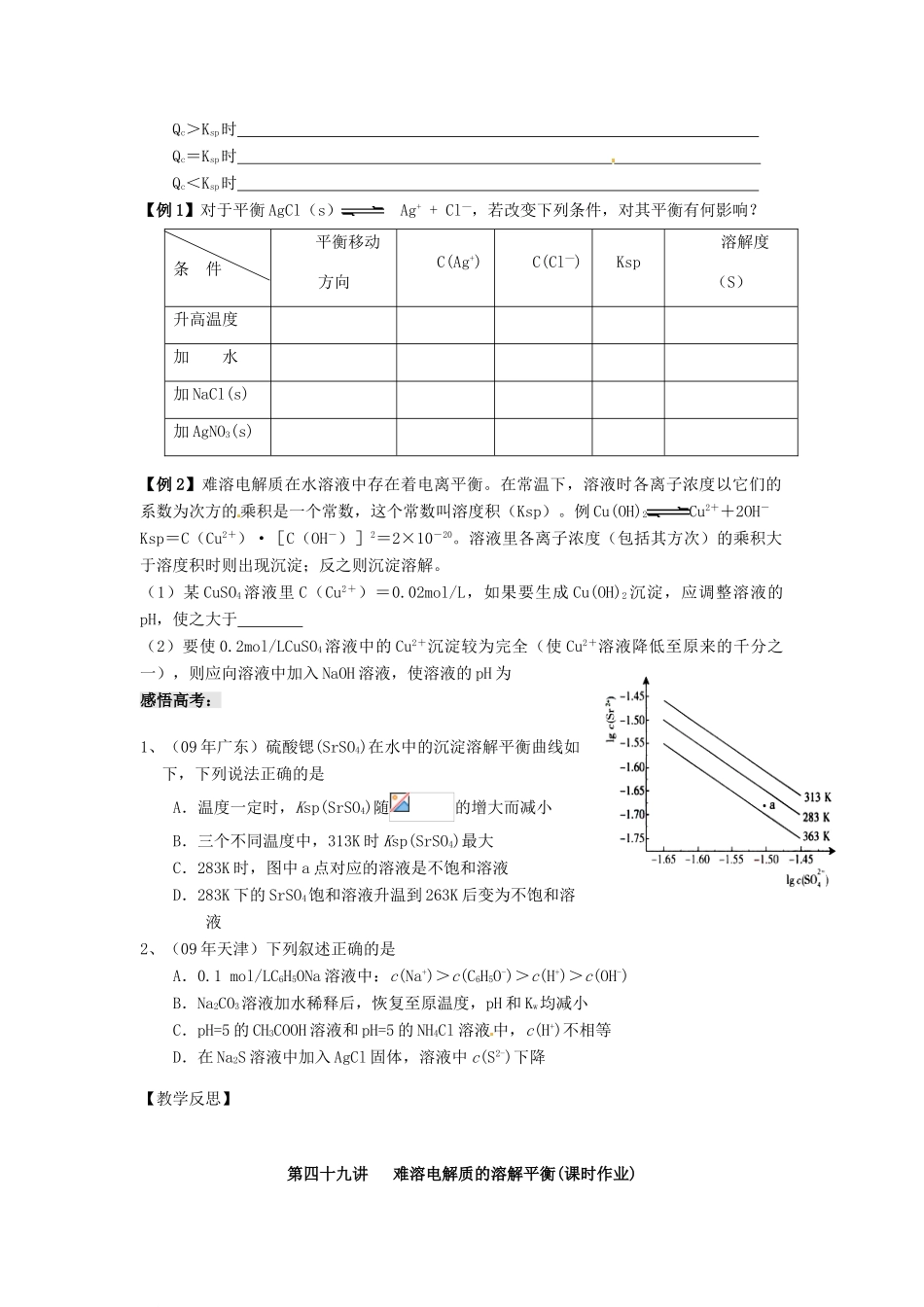
第四十九讲难溶电解质的溶解平衡(两课时)【考试说明】知道难溶电解质的沉淀溶解平衡。【教学设计】一、溶解平衡1.难溶电解质的定义是什么?难溶物的溶解度是否为0?2.当AgNO3与NaCl反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?此溶液是否为AgCl的饱和溶液?3.难溶电解质(如AgCl)是否存在溶解平衡?并写出AgCl的溶解平衡表达式。4.溶解平衡的概念?其有哪些特征?二、沉淀反应的应用1.沉淀的生成(1)沉淀生成的应用:(2)沉淀的方法思考与交流:1)写出使用Na2S、H2S作沉淀剂使Cu2+、Hg2+形成沉淀的离子方程式.2)在生活中,水资源是很宝贵的,如果工业废水中含有Ag+,理论上,你会选择加入什么试剂?3)粗盐提纯时,NaCl溶液中含有SO42-离子,选择含Ca2+还是Ba2+离子的试剂除去?2.沉淀的溶解(1)沉淀溶解的原理:。(2)应用举例:a)难溶于水的盐溶于酸中如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸b)难溶于水的电解质溶于某些盐溶液如:Mg(OH)2溶于NH4Cl溶液c)难溶物因发生氧化还原反应而溶解如:不溶于盐酸的硫化银可溶于硝酸3.沉淀的转化(1)沉淀转化的实质:(2)沉淀转化的应用:如锅炉除水垢(CaSO4),一些自然现象的解释三、溶度积(Ksp)1.概念:2.表达式:对于沉淀溶解平衡MmAnMmn+(aq)+Nam-(aq),Ksp=3.溶度积规则:比较Ksp与溶液中有关离子浓度幂的乘积(离子积Qc)判断难溶电解质在给定条件下沉淀能否生成或溶解。Qc>Ksp时Qc=Ksp时Qc<Ksp时【例1】对于平衡AgCl(s)Ag++Cl—,若改变下列条件,对其平衡有何影响?条件平衡移动方向C(Ag+)C(Cl—)Ksp溶解度(S)升高温度加水加NaCl(s)加AgNO3(s)【例2】难溶电解质在水溶液中存在着电离平衡。在常温下,溶液时各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(Ksp)。例Cu(OH)2Cu2++2OH-Ksp=C(Cu2+)·[C(OH-)]2=2×10-20。溶液里各离子浓度(包括其方次)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解。(1)某CuSO4溶液里C(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于(2)要使0.2mol/LCuSO4溶液中的Cu2+沉淀较为完全(使Cu2+溶液降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液的pH为感悟高考:1、(09年广东)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是A.温度一定时,Ksp(SrSO4)随的增大而减小B.三个不同温度中,313K时Ksp(SrSO4)最大C.283K时,图中a点对应的溶液是不饱和溶液D.283K下的SrSO4饱和溶液升温到263K后变为不饱和溶液2、(09年天津)下列叙述正确的是A.0.1mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降【教学反思】第四十九讲难溶电解质的溶解平衡(课时作业)1、(09年浙江)已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大C.25℃时,Mg(OH)2固体在20mL0.01mol/L氨水中的Ksp比在20mL0.01mol/LNH4Cl溶液中的Ksp小D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF22.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其它电离的离子间的溶解平衡关系:Ba(OH)2(固体)Ba2++2OH-。向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是:()A.溶液中钡离子数目减小B.溶液中钡离子浓度减少C.溶液中氢氧根离子浓度增大D.PH减小3.有关AgCl沉淀的溶解平衡说法正确的是:A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl沉淀的溶解度增大D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变4.除去KCl中的K2CO3应选用下列哪种物质:A.H2SO4B.HClC.HNO3D.三者均可5.为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下,加入一种试剂,过滤后再...