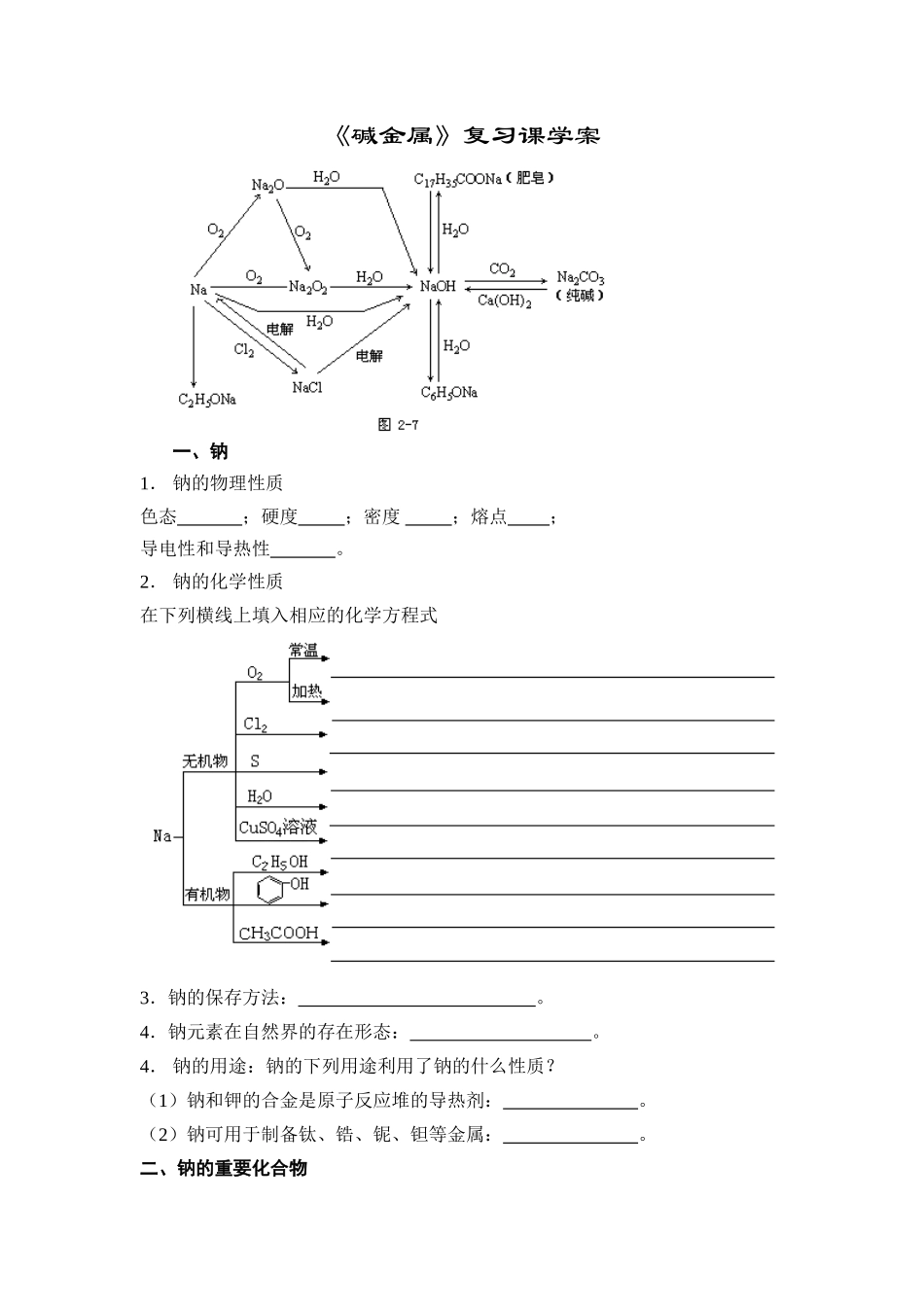
《碱金属》复习课学案一、钠1.钠的物理性质色态;硬度;密度;熔点;导电性和导热性。2.钠的化学性质在下列横线上填入相应的化学方程式3.钠的保存方法:。4.钠元素在自然界的存在形态:。4.钠的用途:钠的下列用途利用了钠的什么性质?(1)钠和钾的合金是原子反应堆的导热剂:。(2)钠可用于制备钛、锆、铌、钽等金属:。二、钠的重要化合物1.钠的氧化物填写下列表格:氧化钠过氧化钠化学式电子式氧元素的化合价色、态稳定性与H2O反应的方程式与CO2反应的方程式用途————二、氢氧化钠写出氢氧化钠与符合下列要求的物质反应的化学方程式(各举一例):三、碳酸钠和碳酸氢钠填写下列表格:Na2CO3NaHCO3俗称色、态水溶性热稳定性与盐酸反应与NaOH溶液反应与CO2反应用途1.碱金属概述:碱金属元素包括(名称及元素符号)(1)周期表中位置:位于周期表中___族相同点:(2)原子结构不同点:(3)相似性:①最高正价为______;②氧化物对应水化物为_______,典型的活泼金属元素;③同类物质结构及性质相似。(4)递变性(按原子序数递增的顺序):①在同周期元素中碱金属原子半径最_____,从Li→Cs,原子半径递_____;②从Li→Cs,失电子能力递_____,金属性递_____,单质还原性递_____,对应阳离子的氧化性_____,其氧化物对应水化物的碱性_____;③单质的熔沸点递_____,硬度递_____,密度_____。2.物理性质:除铯略带金色光泽外,其余的都呈色,都较柔软,有延展性,密度都较,熔点都较,导热导电性能都很____。3.化学性质(1)与O2反应:(2)与H2O反应:(反应程度:从Li→Cs逐渐_______)(3)与盐溶液反应:先考虑与水反应(4)其氧化物、氢氧化物的性质与Na2O、NaOH相似4.焰色反应(1)定义:某些_______或它们的_________在灼热时使火焰呈特殊颜色的现象,在化学上叫做焰色反应。可见,颜色反应并不是化学反应,而应是一种物理现象。主要用于______________________的检验。(2)颜色:钠:_______;钾:______(隔蓝色钴玻璃,目的是滤去________________干扰)。(3)实验:用金属丝(通常可用铂丝或光洁无锈的铁丝或镍、铬、钨丝制成)在酒精灯火焰上灼烧至无色,蘸取试样______(或______)放在火焰上观察。每次实验后,用________洗净金属丝并灼烧至无色(洗净铂丝用________而不用_______,是因为金属的_____盐的沸点比_____盐高,金属氯化物在灼烧时易气化而挥发)。【例6】为了测定某碱金属的相对原子质量,现采用如图所示装置(广口瓶盛满水,干燥管内装有无水氯化钙):具体操作为:先称量整个装置包括仪器、药品共重m1g,将ng该碱金属投入广口瓶内的水中,迅速塞住带有干燥管的橡皮塞,反应完毕后称量整个装置共重m2g。(1)写出碱金属(用R表示)与水反应的离子方程式。(2)该碱金属的相对原子质量的表达式为(3)装置中干燥管的作用是;若没有此干燥管,则测得的碱金属相对原子质量与实际值相比(填“偏大”、“偏小”或“相等”)。