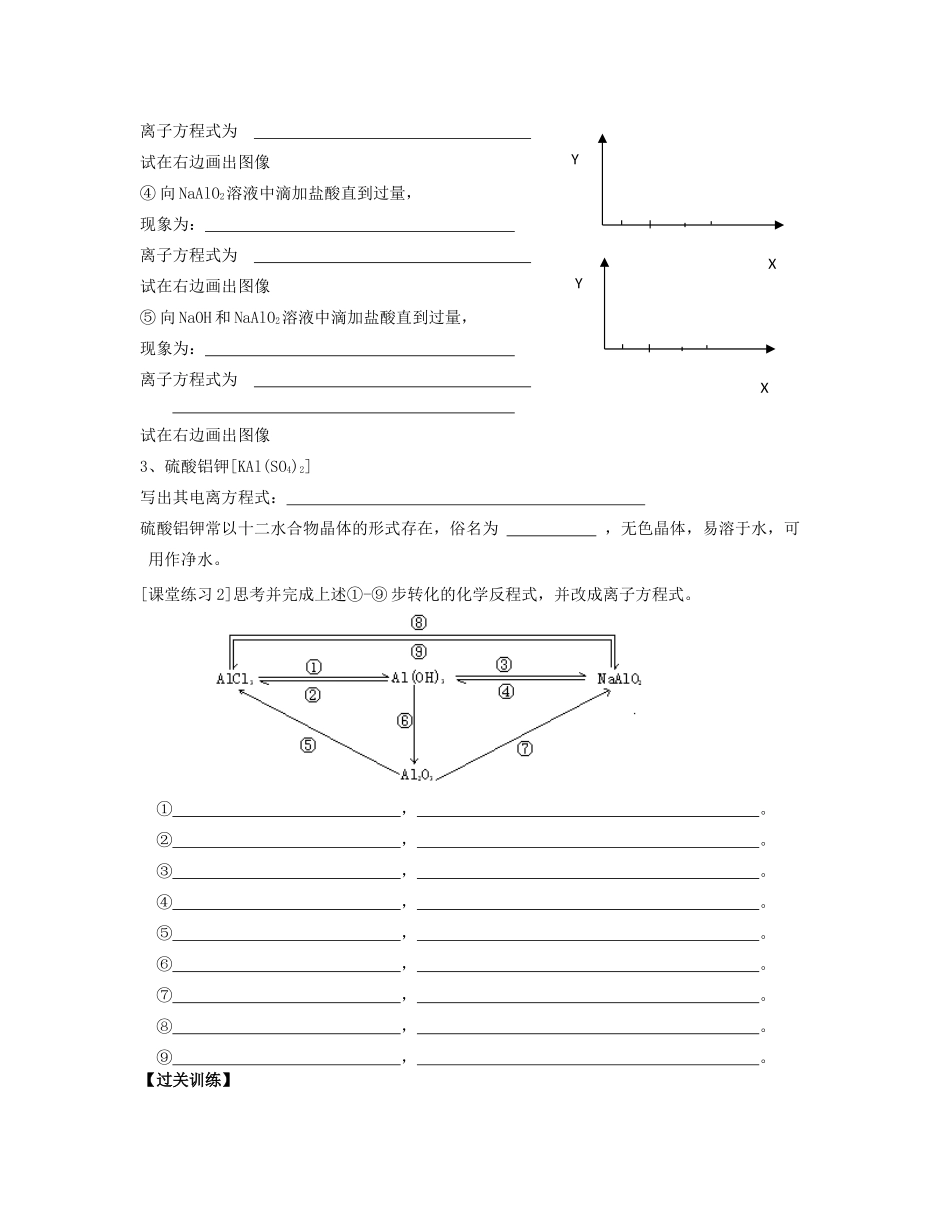
第二节几种重要的金属化合物(2)铝的重要化合物【学习目标】1、掌握Al2O3、Al(OH)3的两性。2、掌握Al(OH)3的制备方法。【学习重点】Al(OH)3的性质和与Al(OH)3有关的计算【复习巩固】1、多数的金属氢氧化物不溶于水,除了等几种碱外。2、不溶于水的金属氢氧化物受热分解,写出下列碱受热分解的化学反程式。Fe(OH)3,Cu(OH)2。3、多数金属氢氧化物都可反应,写出下列碱与HCl反应的化学的离子方程式。Fe(OH)3,Cu(OH)2【自主学习】一、铝的重要化合物1、氧化铝Al2O3是一种色熔点的物质,溶于水,能与盐酸、NaOH溶液反应。Al2O3+HCl离子方程式为:Al2O3+NaOH离子方程式为:Al2O3是一种性氧化物,因为。2、氢氧化铝[实验探究]1、在试管里加入10mL0.5mol/LAl2(SO4)3溶液,滴加氨水,现象为;继续滴加氨水现象为。2、将1中产生的沉淀分装在两个试管中,往一支试管里滴加2moL/L盐酸,往另一支试管滴加2mol/LNaOH溶液。边加边振荡,现象为。[归纳总结]1、氢氧化铝的实验室制法实验原理:(离子方程式)2、氢氧化铝的性质物理性质:氢氧化铝是一种色状的物质;溶于水。化学性质:①与盐酸等酸反应的化学方程式:。与NaOH等碱溶液反应的化学方程式:。氢氧化铝是一种既能与反应,又能与反应的性氢氧化物。原因:②氢氧化铝受热分解方程式:Al(OH)3用途:①医用中和胃酸:化学方程式:②净水剂,利用了其具有性质,能凝聚水中的悬浮物质。[思考与讨论]①能否用Al2O3与水直接反应制取Al(OH)3?如果不能请你设计用Al2O3制取Al(OH)3的实验方案并且写出反应的化学方程式。(填能与不能)原因、。②能否用AlCl3与水直接反应制取Al(OH)3?(填能与不能)原因③偏铝酸钠(NaAlO2)溶液滴加少量稀盐酸,发生反应为NaAlO2+HCl+H2O===Al(OH)3↓+NaCl能否用NaAlO2溶液与稀盐酸直接反应制取Al(OH)3?(填能与不能)原因[知识扩展]用NaAlO2溶液制取Al(OH)3的方法:向NaAlO2溶液通入CO2,发生如下反应:2NaAlO2+3H2O+CO2===2Al(OH)3↓+Na2CO3,生成的氢氧化铝不溶于碳酸,如果继续通入CO2,此时发生反应的离子方程式为[课堂练习]①向AlCl3溶液中滴加NaOH溶液直到过量,现象为:离子方程式为试在右边画出生成的沉淀量Y与加入试剂的量X的关系的图像(简称画图像下同)②向MgCl2和AlCl3溶液中滴加NaOH溶液直到过量,现象为:离子方程式为试在右边画出图像③向HCl、MgCl2和AlCl3溶液中滴加NaOH溶液直到过量,现象为:H++AlO2-+H2OAl(OH)3Al3++3OH-酸式电离碱式电离YXYXYX离子方程式为试在右边画出图像④向NaAlO2溶液中滴加盐酸直到过量,现象为:离子方程式为试在右边画出图像⑤向NaOH和NaAlO2溶液中滴加盐酸直到过量,现象为:离子方程式为试在右边画出图像3、硫酸铝钾[KAl(SO4)2]写出其电离方程式:硫酸铝钾常以十二水合物晶体的形式存在,俗名为,无色晶体,易溶于水,可用作净水。[课堂练习2]思考并完成上述①-⑨步转化的化学反程式,并改成离子方程式。①,。②,。③,。④,。⑤,。⑥,。⑦,。⑧,。⑨,。【过关训练】YXYX1、下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是()①Al2O3②MgO③NaHCO3④Al(OH)3A.①②③B.①②④C.①③④D.②③④2、向硫酸铝溶液中滴加下列试剂,有沉淀产生,且沉淀不会因加入试剂过量而消失的是A.NaOHB.NH3·H2OC.NaClD.BaCl23、下列物质受热不易分解的氢氧化物是()A.Al2O3B.NaOHC.Mg(OH)2D.Fe2O34、下列方法不能够生成Al(OH)3的是()A.向AlCl3溶液中滴加Ba(OH)2溶液B.向AlCl3溶液中滴加氨水C.向NaAlO2溶液中通入CO2D.向NaAlO2溶液中滴加过量的HCl5、镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有()A.Na+B.Al3+C.Cu2+D.6、下列反应的离子方程式中,有错误的是()A.氢氧化铝和盐酸:Al(OH)3+3H+=Al3++3H2OB.氧化铝溶于氢氧化钠:Al2O3+2OH-=2AlO2-+2H2OC.铁溶于稀硫酸:Fe+2H+=Fe2++H2↑D.氢氧化铝溶于氢氧化钠溶液:Al(OH)3+3OH-=AlO2-+3H2O7、在无色透明的溶液中能大量共存的是()A.HCO3-、Na+、OH-、Cl-B.Ca2+、NO3-、SO42-、CO32-C.Fe...