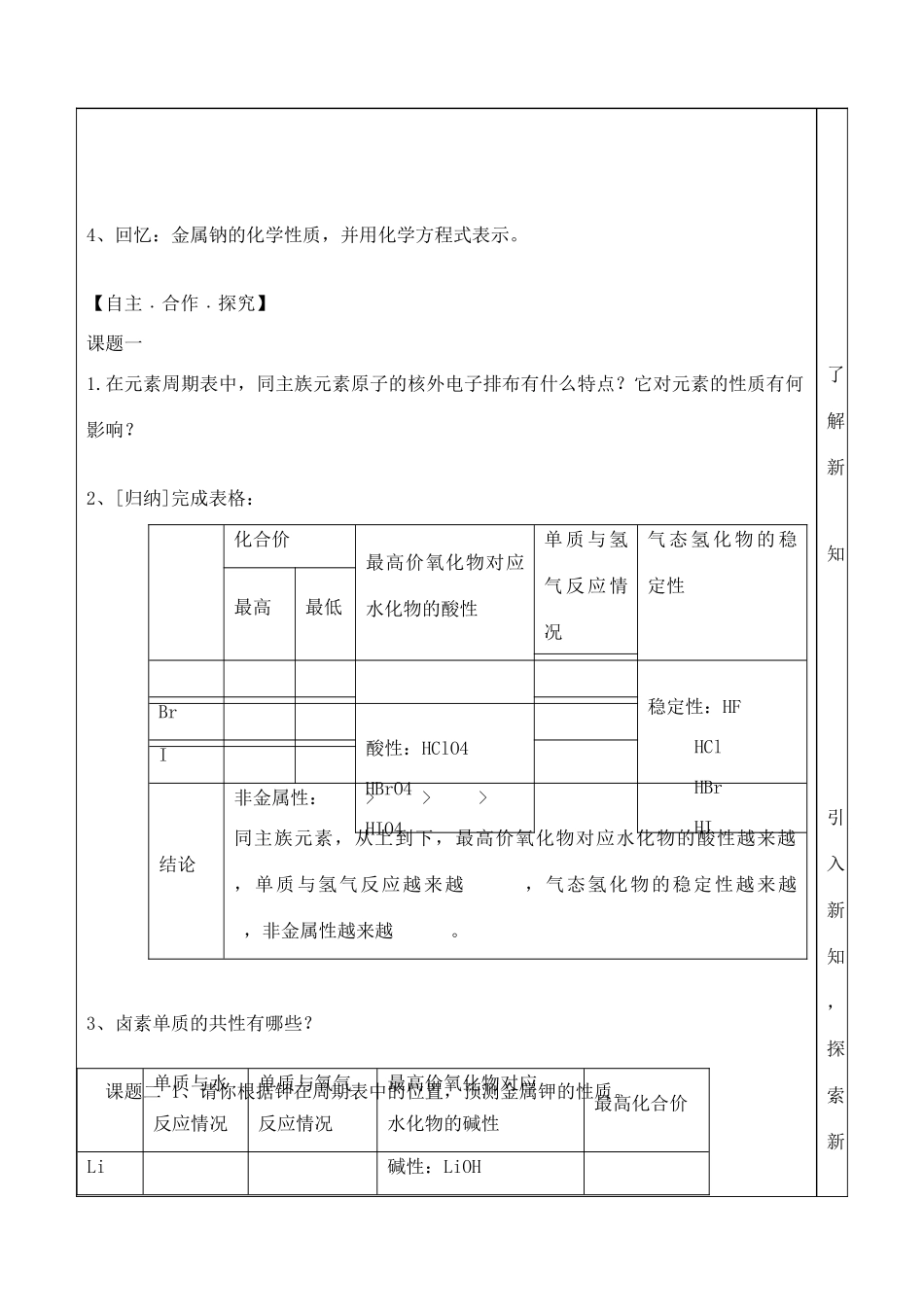
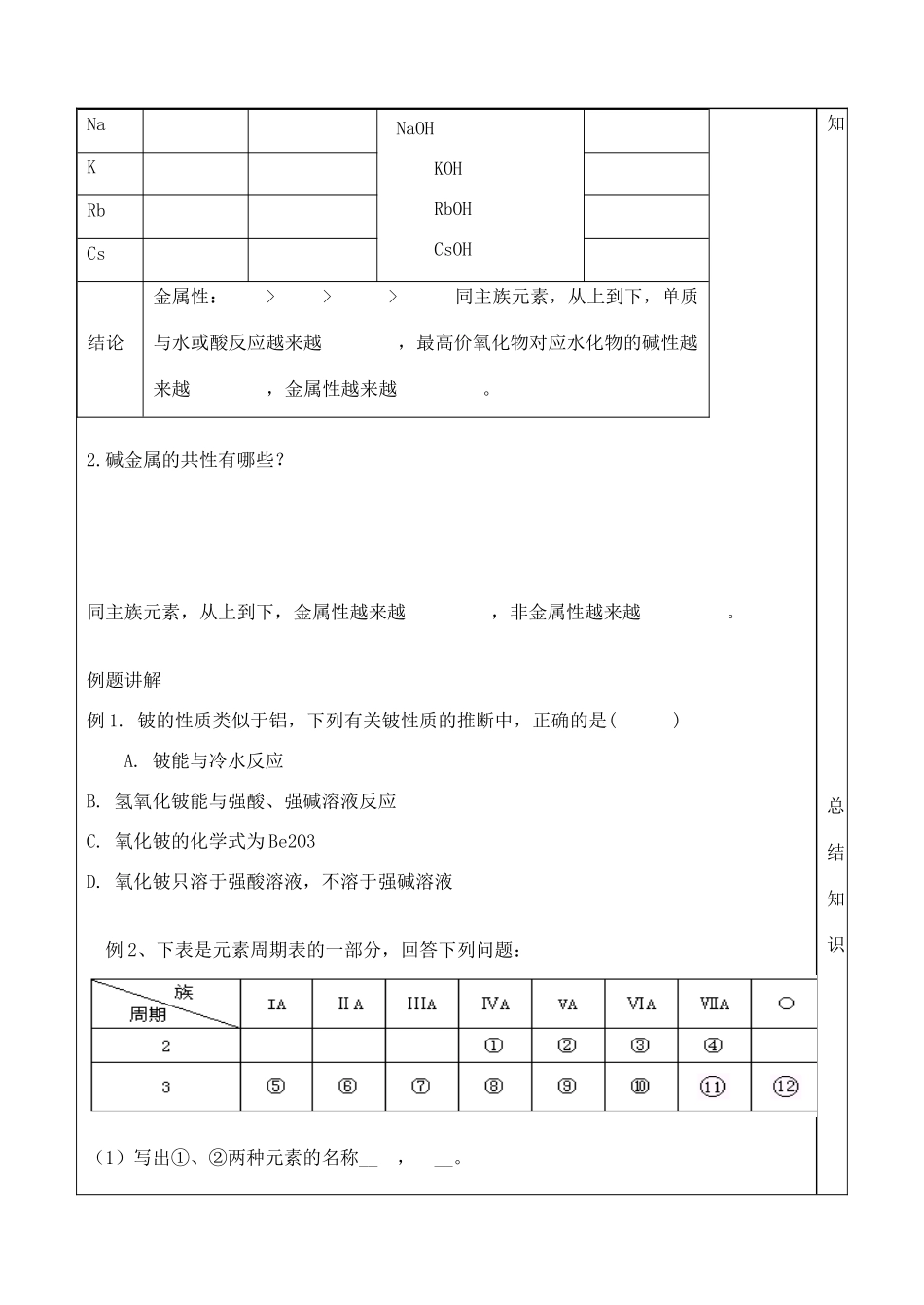
山东省泰安市肥城市第三中学高中化学元素周期表应用(第二课时)学案鲁科版必修2学习内容学习指导感悟学习目标:1.ⅦA、ⅠA族元素为例,使学生掌握同主族元素性质递变规律,并能用原子结构理论初步加以解释;2.培养学生实验能力以及对实验结果的分析、处理和总结能力;学习重点同主族元素性质递变规律学习难点:同主族元素性质递变规律【回顾﹒预习】1、比较元素原子得电子能力强弱的间接判断方法有:①②2、ⅦA族元素包括,试写出它们的原子结构示意图:它们结构上相同点有?不同点有?3、写出以前学习过的Cl2、Br2、I2化学性质的化学方程式或者离子方程式,并归纳它们性质上的相同点和不同点自我完成,回顾知识。4、回忆:金属钠的化学性质,并用化学方程式表示。【自主﹒合作﹒探究】课题一1.在元素周期表中,同主族元素原子的核外电子排布有什么特点?它对元素的性质有何影响?2、[归纳]完成表格:化合价最高价氧化物对应水化物的酸性单质与氢气反应情况气态氢化物的稳定性最高最低稳定性:HFHClHBrHI酸性:HClO4HBrO4HIO4BrI结论非金属性:>>>同主族元素,从上到下,最高价氧化物对应水化物的酸性越来越,单质与氢气反应越来越,气态氢化物的稳定性越来越,非金属性越来越。3、卤素单质的共性有哪些?课题二1、请你根据钾在周期表中的位置,预测金属钾的性质。单质与水反应情况单质与氧气反应情况最高价氧化物对应水化物的碱性最高化合价Li碱性:LiOH了解新知引入新知,探索新NaOHKOHRbOHCsOHNaKRbCs结论金属性:>>>同主族元素,从上到下,单质与水或酸反应越来越,最高价氧化物对应水化物的碱性越来越,金属性越来越。2.碱金属的共性有哪些?同主族元素,从上到下,金属性越来越,非金属性越来越。例题讲解例1.铍的性质类似于铝,下列有关铍性质的推断中,正确的是()A.铍能与冷水反应B.氢氧化铍能与强酸、强碱溶液反应C.氧化铍的化学式为Be2O3D.氧化铍只溶于强酸溶液,不溶于强碱溶液例2、下表是元素周期表的一部分,回答下列问题:(1)写出①、②两种元素的名称__,__。知总结知识(2)写出⑧、⑨两种元素的符号_____。(3)在这些元素中,____是最活泼的金属元素;____是最活泼的非金属元素;____是最不活泼的元素。(用元素符号填写)(4)这些元素的最高价氧化物对应水化物中最强的酸是________;最强的碱是________;两性氢氧化物是______。(填化学式)(5)从⑤到的元素中,________原子半径最小。(用元素符号填写)(6)比较⑤与⑥的化学性质,________(用元素符号填写)更活泼,试用实验证明此现象(简述操作、现象和结论)_______________________________【当堂达标】1、镭是元素周期表中第ⅡA族元素,下列关于镭的叙述不正确的是()A.镭比钙的金属性更强B.在化合物中是+2价C.镭是一种放射性元素D.氢氧化镭呈两性2、下列各组中的性质比较中,不正确的是()A酸性HClO4>HBrO4>HIO4B碱性Ba(OH)2>Ca(OH)2>Mg(OH)2C还原性F->Cl->Br-D稳定性HCl>H2S>PH33、下列关于碱金属性质的叙述中正确的是()A它们都能在空气中燃烧生成氧化物B它们都能与水反应生成氢气和碱C所形成的阳离子的氧化性依次减弱D碱金属中密度最小、熔沸点最高的是铯4、随着卤素原子半径的增大,下列递变规律正确的是()A单质的熔沸点逐渐降低B卤素离子的还原性逐渐增强C气态氢化物的稳定性逐渐增强D单质的氧化性逐渐增强5、可用来判断金属性强弱的依据是()A、原子电子层数的多少B、最外层电子数的多少分析题目、总结方法C、最高价氧化物的水化物的碱性强弱D、等物质的量的金属置换氢气的多少【反思﹒提升】【拓展﹒延伸】1、短周期中三元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是:A.a是一种活泼的非金属元素B.c的最高价氧化物的水化物是一种弱酸C.b的氢化物很稳定D.b元素的最高化合物为+7价。2.(1)某主族元素的负一价阴离子核外有四个电子层,该元素在周期表中的位置是。(2)某主族元素的正一价阳离子核外有四个电子层,该元素在周期表中的位置是:。(3)A+B-具有相同的电子层排布,则它们是否是同一周期的元素。若A是第三周期元素,则B是参考答案【拓展﹒延伸】Babc