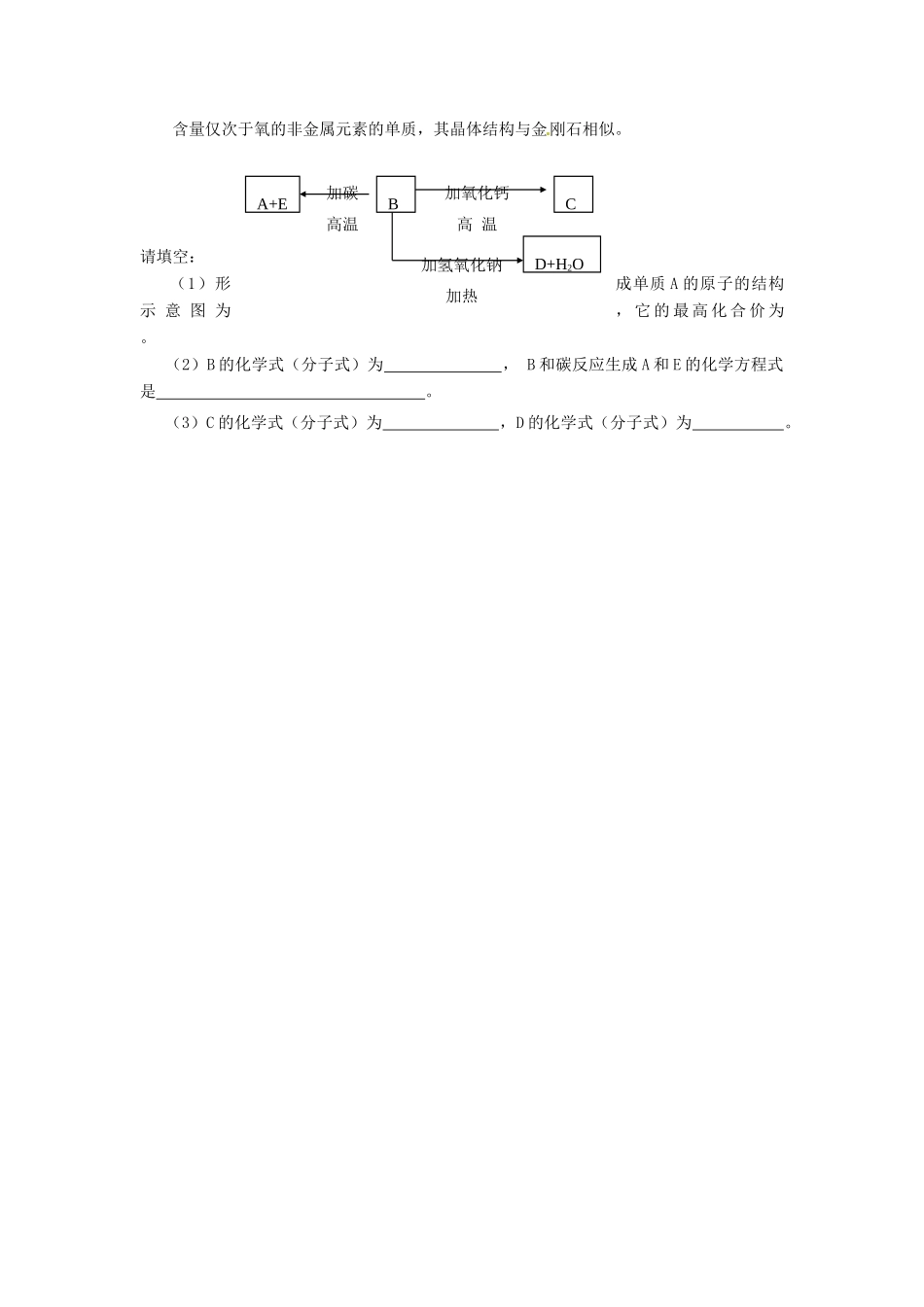
河北省邯郸四中高一化学《332含硅矿物与信息材料》导学案自主学习一、硅:(1)存在:以化合态存在于自然界,在地壳中的含量居第二位。(2)物理性质:熔沸点,硬度,半导体。(3)化学性质:常温下性质,很难发生反应。但可与NaOH溶液,F2,HF反应。与NaOH溶液反应与F2反应与HF反应(4)硅的用途:导电性介于与之间,是重要的材料,可用来制集成电路,晶体管等。(5)硅的工业制法:工业上用碳和二氧化硅在高温下反应制取硅。(粗硅)硅的提纯二、二氧化硅:(酸性氧化物)(1)存在:存在于岩石中,、、、都含有SiO2。(2)物理性质:熔沸点,硬度。(3)化学性质:a.酸性氧化物的性质:。b.与HF反应。c.与C反应。(4)用途:光导纤维、化学仪器、光学仪器、钟表、电子部件二氧化硅的用途。合作探究区别SiO2和CO2性质比较物质二氧化硅(SiO2)二氧化碳(CO2)物理性质化学与水反应与酸反应性质与碱反应与碱性氧化物反应与碳反应存在存在于岩石中,硅石石英水晶硅藻土都含有SiO2空气用途光导纤维、化学仪器、光学仪器、钟表、电子部件饮料、制碱思考:为何实验室盛放NaOH的试剂瓶不用玻璃塞?(用方程式来解释)【达标反馈】1.二氧化硅是一种熔沸点很高的、硬度很大的氧化物,下列有关二氧化硅用途的说法不正确的是()A.用于制作光学镜片B.制造光导纤维C.制石英坩埚D.与水直接反应制硅酸2.玻璃的主要成分之一是二氧化硅,常温下,能跟二氧化硅反应的物质是()A.纯碱溶液B.浓硫酸C.氢氟酸D.浓硝酸3.下列反应中属于氧化还原反应的是()A.Si+2NaOH+H2O=Na2SiO3+2H2↑B.PbO+H2SO4=PbSO4+H2OC.Na2SiO3+6HF=Na2SiF6+3H2OD.SiO2+4HF=SiF4+2H2O4、为了除去下列各粉状混合物中的杂质(括号中为杂质),请选用下列提供的试剂和操作代号填入表内,并写出有关反应化学方程式。试剂:A、盐酸B、烧碱溶液C、氧气D、水E、二氧化碳F、不用任何试剂操作:a、燃烧b、高温灼烧c、过滤d、蒸发试剂含杂质的物质所加试剂主要操作化学方程式SiO2(CaCO3)CaCO3(SiO2)SiO2(Si)SiO2(H2SiO3)二、填空题1.在Na2SiO3溶液中通入过量CO2气体生成白色沉淀,此沉淀不溶于盐酸,但能溶于氢氧化钠溶液重新生成Na2SiO3,试写出该反应的离子方程式2.A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。请填空:(1)形成单质A的原子的结构示意图为,它的最高化合价为。(2)B的化学式(分子式)为,B和碳反应生成A和E的化学方程式是。(3)C的化学式(分子式)为,D的化学式(分子式)为。A+EBCD+H2O加碳高温加氧化钙高温加氢氧化钠加热