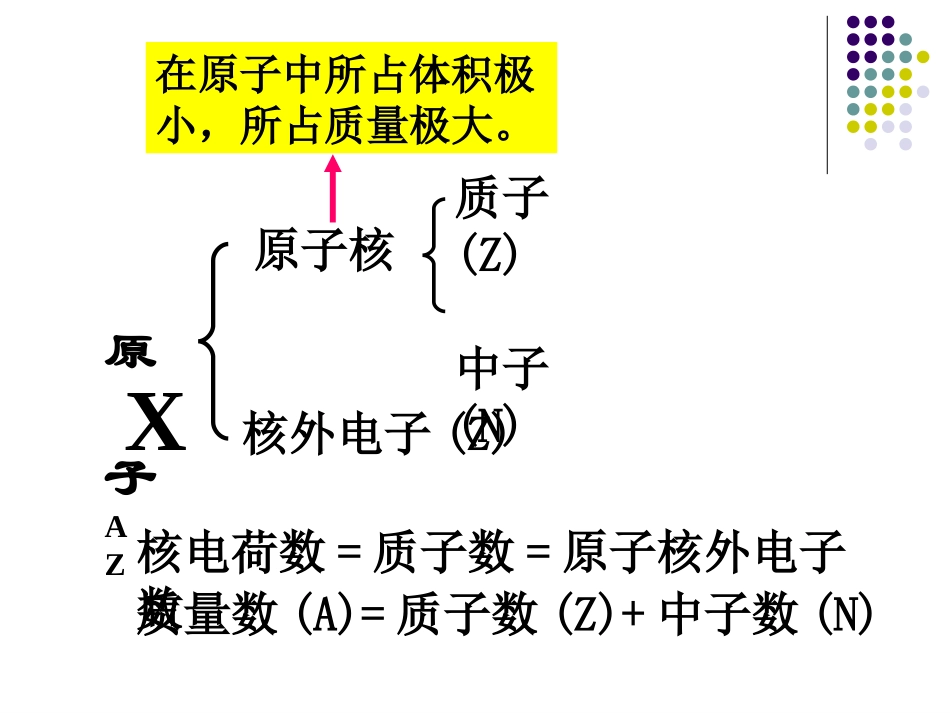
化学Ⅱ第一节元素周期表质子(Z)中子(N)核外电子(Z)原子AZX在原子中所占体积极小,所占质量极大。核电荷数=质子数=原子核外电子数质量数(A)=质子数(Z)+中子数(N)原子核一、原子核外电子排布1、电子层:不同的能量区域。电子层模型示意图观察表1-2,结合初中有知识,结合前面学过的碱金属元素,卤族元素的原子结构示意图,找出其排布的规律。2、原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里。②每个电子层最多只能排布2n2个电子。③K层为最外层时,最多只能容纳2个电子。④其它各层为最外层时,最多只能容纳8个电子。⑤次外层最多不超过18个电子。[思考与交流](观察元素周期表)我们按照元素在周期表中的顺序给元素编号,得到原子序数。可见原子序数与原子结构间存在什么关系?(结合1-18号元素原子结构)元素周期表的编排原则?原子序数=核电荷数=质子数=核外电子数把相同电子层数的元素排列在一个横行里,把最外层电子数相同的元素按照原子序数递增的顺序排在同一纵行Na11钠H1氢He2氦Li3锂Be4铍B5硼C6碳N7氮O8氧F9氟Ne10氖Mg12镁Al13铝Si14硅P15磷S16硫Cl17氯Ar18氩K19钾Ca20钙IAIIAIIIAIVAVAVIAVIIA01234族:具有相同的最外层电子数的列周期:具有相同的电子层数的行元素周期表A:主族Sc21钪Ti22钛V23钒Cr24铬Mn25锰Fe26铁Co27钴Ni28镍Cu29铜Zn30锌IIBIBVIIIVIIBVIBVBIVBIIIBB:副族[归纳与整理](二)编排原则:⑴按原子序数的递增顺序从左到右排列⑵将电子层数相同的元素排列成一个横行⑶把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行。(一)关系:原子序数=核电荷数=质子数=核外电子数[思考与交流]元素周期表中有多少横行、纵行?什么是周期?什么是族?7/1811211111010910810710610510489-10380797877767574737257-714847464544434241403930292827262524232221868584838281545352515049363534333231181716151413109876528887565538372019121143176541882MLk382LK22K11031021011009998979695949392919089717069686766656463626160595857元素周期表IAIIAIIIAIVAVAVIAVIIA0IIIBIVBVBVIBVIIBVIIIIBIIB锕系镧系主族周期副族过渡元素(三)元素周期表的结构周期短周期长周期第1周期:2种元素第2周期:8种元素第3周期:8种元素第4周期:18种元素第5周期:18种元素第6周期:32种元素不完全周期第7周期:26种元素镧系元素共15种元素锕系元素共15种元素周期序数=电子层数(横行)[归纳与整理][课堂练习]请大家根据元素周期表,完成下表内容。类别周期序数起止元素包括元素种数核外电子层数短周期1H—He2Li—Ne3Na—Ar长周期4K—Kr5Rb—Xe6Cs—Rn不完全周期7Fr—112号288181832261234567(三)元素周期表的结构族主族:副族:ⅠA,A,A,A,A,A,AⅡⅢⅣⅤⅥⅦ第VIII族:稀有气体元素主族序数=最外层电子数(纵行)零族:共七个主族ⅠB,B,B,B,B,B,BⅡⅢⅣⅤⅥⅦ共七个副族三个纵行(8、9、10)[归纳与整理]族的别称ⅠA称为元素ⅡA称为元素ⅣA称为元素ⅤA称为元素ⅥA称为元素ⅦA称为元素零族称为元素碱金属碱土金属碳族氮族氧族卤族稀有气体思考:Cl的位置的描述:第七主族VII族VIIA族第III周期第三周期第3周期第三周期VIIA族小结元素周期表的结构:七主七副七周期,熟记:三个短周期元素(1~18号元素)的元素符号和名称。Ⅷ族零族镧锕系。ⅠA,ⅦA族元素的元素符号和名称。三、元素周期表和元素周期律的应用(一)、元素的位置、结构、性质三者的关系(1)、同一周期,从左到右,(2)、同一主族,从上到下,金属性逐渐减弱,非金属性逐渐增强金属性逐渐增强,非金属性逐渐减弱1、元素的金属性和非金属性与元素在周期表中位置关系。1BAlSiGeAsSbTe234567ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0PoAt非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强半导体学与问•P16什么元素的金属性最强?什么元素的非金属性最强?它们分别位于元素周期表中的什么位置?铯(Cs)氟(F)非金属性强弱判断依据:1、非金属元素单质与H2化合的难易程度,化合越容易,非金属性也越强。2、形成气态氢化物的稳定性,气态氢化物越稳定,元素的非金属性也越强...