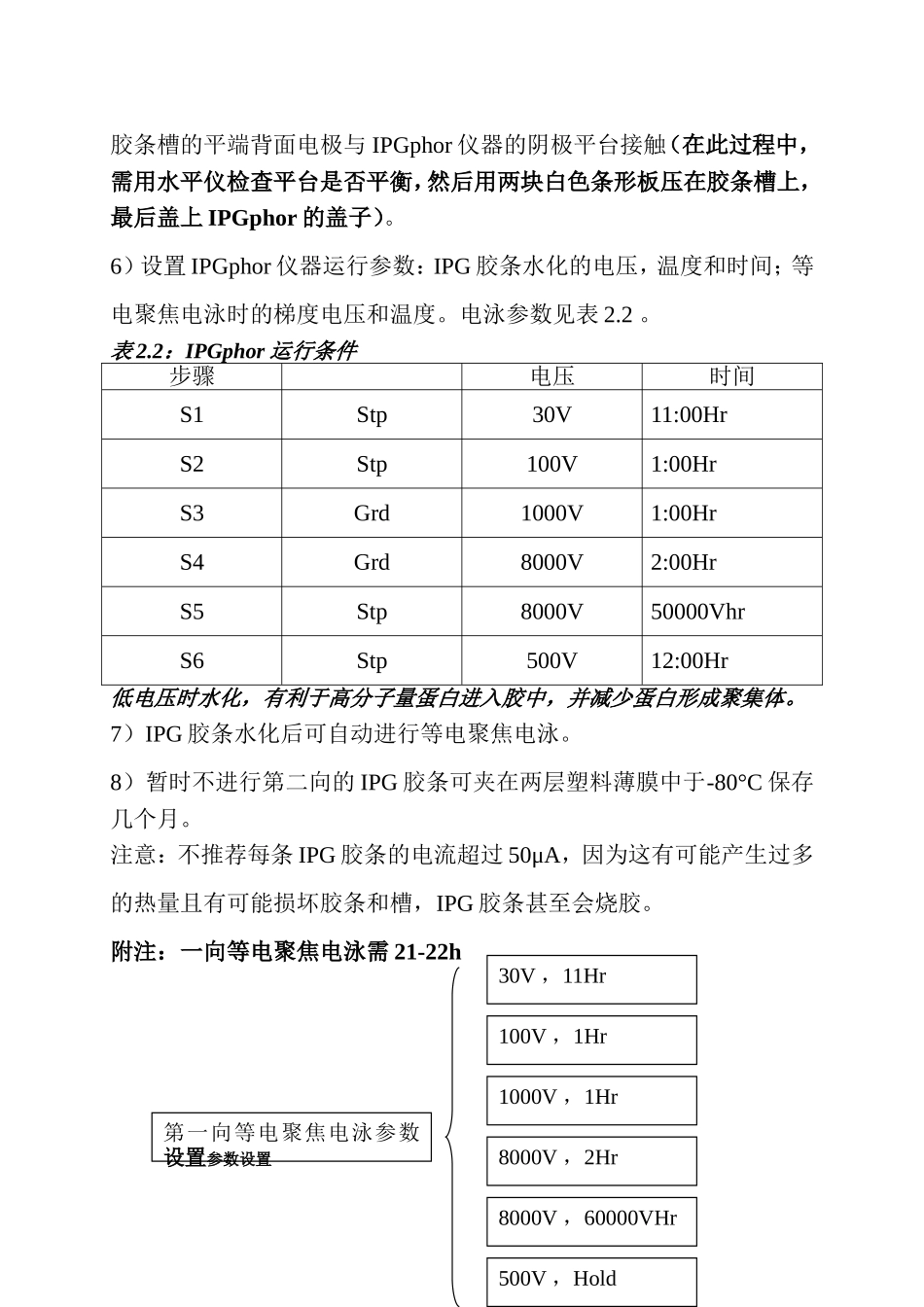
第一向等电聚焦(IEF)图示:EttanIPGphor3等电聚焦仪器和EttanIPGphor3控制软件双向电泳的第一向IEF电泳采用IPGphor,实验将变得很简单。IPGphor包括半导体温控系统(18°C-25°C)和程序化电源(8000V,1.5mA)。可采用普通型胶条槽一步完成胶条的水化、上样和电泳,大大减少操作步骤。IPGphor一次可进行12个胶条槽的电泳(7,11,13,18,24cm),因采用高电压(8000V),可缩短聚焦时间。最新推出的通用型杯上样胶条槽因采用可移动的上样杯和电极,适合任何长度的IPG胶条,尤其适合极性等电点蛋白的分离。1.IPG胶条的水化和电泳(1)仪器:IPGphor(2)试剂:水化液(8M尿素,2%CHAPS,15mMDTT和0.5%IPG缓冲液):水化液需当天新鲜配制(可配成储液分装-20℃保存,但不可反复冻融,尿素溶液加热温度不能超过37°C,否则蛋白会发生氨甲酰化)。(3)实验步骤:1)用样品溶解缓冲液(9M尿素,4%CHAPS,2%IPG缓冲液,40mMDTT,40mMTris-base)溶解样品。蛋白质上样浓度不要超过10mg/ml(若浓度过高,可以加Lysisbuffer稀释),否则会造成蛋白质的集聚或沉淀。2)吸取适量(见表2.1)含有样品的水化液放入标准型胶条槽中,为确保样品充分进入胶条中,不要加入过量的水化液。表2.1IPG胶条所需水化液体积3)从酸性端(尖端)一侧剥去IPG胶条的保护膜,胶面朝下,先将IPG胶条尖端(阳性端)朝标准型胶条槽的尖端方向放入胶条槽中(酸性端抵住胶条槽底端),慢慢下压胶条,并前后移动,避免生成气泡,最后放下IPG胶条平端(阴极),使水化液浸湿整个胶条,并确保胶条的两端与槽的两端的电极接触。4)IPG胶条上覆盖适量(1.5mL)ImmobilineDryStrip覆盖油(从两侧往中间加),盖上盖子。5)将标准型胶条槽的尖端背面电极与IPGphor仪器的阳极平台接触;胶条槽的平端背面电极与IPGphor仪器的阴极平台接触(在此过程中,需用水平仪检查平台是否平衡,然后用两块白色条形板压在胶条槽上,最后盖上IPGphor的盖子)。6)设置IPGphor仪器运行参数:IPG胶条水化的电压,温度和时间;等电聚焦电泳时的梯度电压和温度。电泳参数见表2.2。表2.2:IPGphor运行条件步骤电压时间S1Stp30V11:00HrS2Stp100V1:00HrS3Grd1000V1:00HrS4Grd8000V2:00HrS5Stp8000V50000VhrS6Stp500V12:00Hr低电压时水化,有利于高分子量蛋白进入胶中,并减少蛋白形成聚集体。7)IPG胶条水化后可自动进行等电聚焦电泳。8)暂时不进行第二向的IPG胶条可夹在两层塑料薄膜中于-80°C保存几个月。注意:不推荐每条IPG胶条的电流超过50μA,因为这有可能产生过多的热量且有可能损坏胶条和槽,IPG胶条甚至会烧胶。附注:一向等电聚焦电泳需21-22h第一向等电聚焦电泳参数设置参数设置30V,11Hr100V,1Hr1000V,1Hr8000V,2Hr8000V,60000VHr500V,Hold2.IPG胶条的平衡IPG胶条平衡两次,每次15min。平衡缓冲液包括6M尿素和30%甘油,会减少电内渗,有利于蛋白从第一向到第二向的转移。第一步平衡在平衡液中加入DTT,使变性的非烷基化的蛋白处于还原状态;第二步平衡步骤中加入碘乙酰胺,使蛋白质巯烷基化,防止它们在电泳过程中重新氧化,碘乙酰胺并且能使残留的DTT烷基化(银染过程中,DTT会导致点拖尾"pointstreaking")。将IPG胶条轻轻润洗,并去除多余的平衡缓冲液,然后放入第二向SDS胶中。注:如果缩短平衡时间,会影响一部分蛋白从IPG胶条转移到SDS胶的效率。这种情况下建议在蛋白从IPG胶条转移到SDS胶后,将IPG胶条染色,以检查是否所有蛋白都已离开IPG胶条。(1)仪器:平衡管(200mm长,20mmi.d.),Parafilm,水平式摇床(2)实验步骤:1)使用前每10ml平衡缓冲液中加入0.1gDTT(相当于平衡缓冲液I),取出IPG胶条分别放入平衡管中(支持膜贴着管壁,每个平衡管中放入一条IPG胶条),用Parafilm封口,报纸盖上平衡管,避光,在水平式摇床上摇晃15分钟,倒掉平衡缓冲液I。2)每10ml平衡缓冲液加入0.3g碘乙酰胺(相当于平衡缓冲液II)。将IPG胶条转移至平衡缓冲液II中,用Parafilm封口,报纸盖上平衡管,避光,在水平式摇床上摇晃15分钟。(注:平衡缓冲液Ⅰ和Ⅱ用同一平衡管,即先用DDT平衡,缓缓地倒掉DDT,小心别把IPG胶条倒掉,再加入IAA进行平衡即可。每根胶...