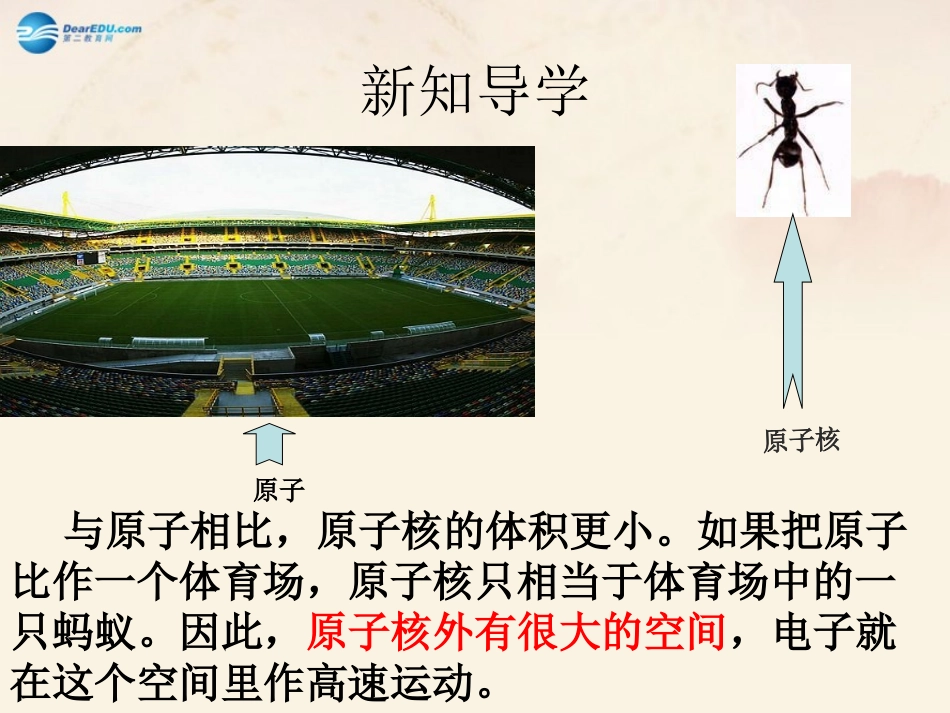
第2课时原子的结构1.初步了解核外电子是分层排布的及原子结构示意图的含义,知道原子的性质与最外层电子排布之间的关系。2.了解离子的概念及离子的形成过程。3.构成物质的粒子除原子、分子外,还有离子。带电的原子叫做离子。新知导学原子原子核与原子相比,原子核的体积更小。如果把原子比作一个体育场,原子核只相当于体育场中的一只蚂蚁。因此,原子核外有很大的空间,电子就在这个空间里作高速运动。原子核外电子的排布1.核外电子的运动状况?2.电子是否像行星绕太阳旋转有固定的轨道?3.什么叫做电子的分层排布?自学课本P54页的内容,完成以下问题:(8分钟)1.核外电子的运动状况:(1)高速无规则运动;(2)具有能量;(3)能量不完全相同。离核远近低高近远电子能量2.电子不像行星绕太阳旋转有固定的轨道,但有经常出现的区域,科学家把这样的区域称为电子层。3.离核最近的为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫最外层。核外电子的这种分层运动又叫做分层排布。电子层1234567思考:1.能否用一个更简明的图形来表示原子的核外电子排布规律?2.核外电子有什么排布规律?自己阅读图3-11和图3-12,完成以下问题(5分钟)2.核外电子的排布规律:(1)第一层最多排2个电子;第二层最多排8个电子;(2)最外层最多排8个电子(第一层为最外层则最多排2个电子);(3)根据能量最低原理,先排满第一层,再排第二层,依次向外。原子结构的简明表示1.原子结构示意图:画法:画圆圈,标核电,弧线呈扇面,数字一条线。2+86原子核核电荷数(质子数)电子层电子层上的电子数1.判断下列原子结构示意图的正误OAlFNaPLi学以致用+11+22+321+422+523+624+725+826+927+1028+11281+12282+13283+14284+15285+16286+17287+18288氢H氦He锂Li铍Be硼B碳C氮N氧O氟F氖Ne钠Na镁Mg铝Al硅Si磷P硫S氯Cl氩Ar读图探索(自主阅读图3-12和P55页第一段,完成以下问题5分钟)1.什么样的结构才是原子的相对稳定结构?2.分析稀有气体、金属原子、非金属原子的最外层电子数有什么特点?3.原子的化学性质与什么关系最密切?注意原子最外层电子数为8个,或只有一个电子层时为2个,这样的结构被认为是相对稳定结构。(1)稀有气体:原子的最外层电子数为8(氦为2个),达到相对稳定结构。稀有气体的化学性质很稳定。(2)金属:原子的最外层电子数一般少于4个,在化学反应中容易失去电子,形成稳定结构。(3)非金属:原子的最外层电子数一般多于4个,在化学反应中容易得到电子,形成稳定结构。结论:原子的化学性质(是否稳定,在化学反应是容易得电子,还是容易失电子)由原子的最外层电子数决定。2.下列五种微粒中最易失去电子的是,最易得到电子的是_。ABC+1028+1128+11281+12282+17287DEAE由于金属原子、非金属原子的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,得失电子的结果怎样呢?反思原子失去电子后,变成什么微粒呢?思考:(自己阅读P55页剩下的部分,完成下列问题,5分钟)1.离子的概念?2.离子的分类,阳离子、阴离子的概念?3.构成物质的微粒除了分子、原子之外,还有什么?二、离子—带电荷的原子1.分类阴离子—带负电荷的原子阳离子—带正电荷的原子2.构成物质的粒子除原子、分子外,还有离子。3.离子符号的意义Mg2+每个镁离子带2个单位的正电荷表示元素符号原子阳离子阴离子失电子得电子失电子得电子原子中:质子数=电子数阳离子中:质子数>电子数阴离子中:质子数<电子数知识拓展(原子不带电)(带正电)(带负电)【典例3】(2012•泰安中考)如图是硫原子的原子结构示意图,下列对硫原子的叙述正确的是()A.硫原子第一电子层有6个电子B.硫原子核内有16个质子C.硫原子最外层电子的能量低于第二层电子的能量D.硫原子在化学反应中容易失去电子B知识点三、核外电子的排布【典例4】下列说法中正确的是()A.结构示意图为的粒子一定是氖原子B.Mg2+的核电荷数是12,则其核外电子数为14C.Na和Na+的化学性质相同D.原子变成离子时,得失电子都有可能知识点四、离子的形成D一、原子的构成中子(不带电)1.原子原子核(+)核外电子()...