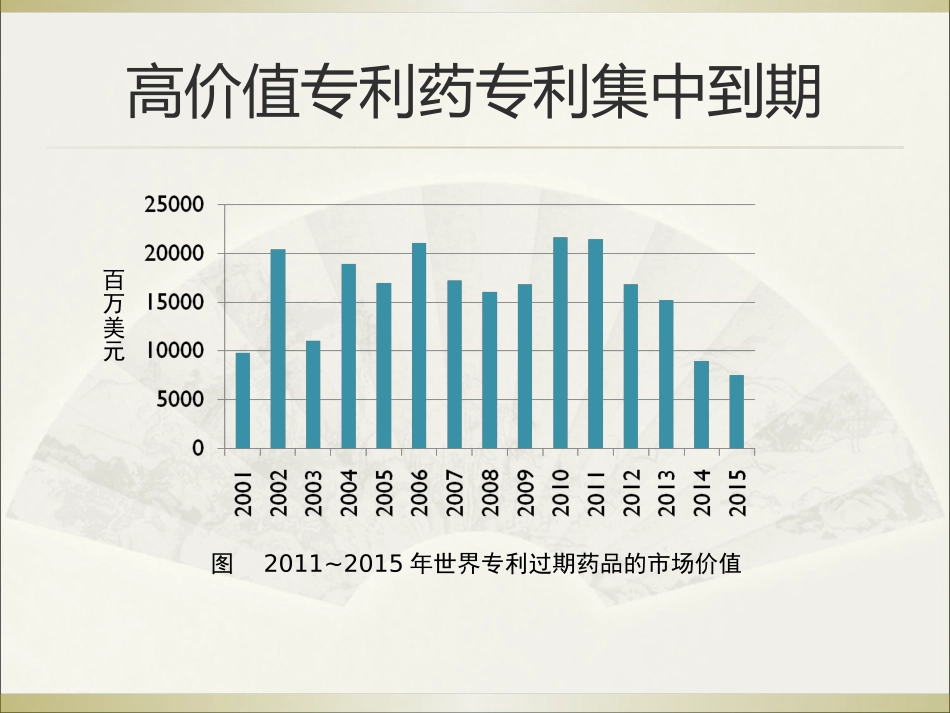
中国仿制药研发的机遇与前景展望2012-09仿制药发展的机遇高价值专利药专利集中到期图2011~2015年世界专利过期药品的市场价值百万美元全球畅销药专利集中到期到2011年,治疗溃疡、降压调脂、抗菌、抗肿瘤等全球35种畅销药的专利将集中到期,市场预计销售额达820亿美元。“重磅炸弹”药物的研发速度远低于专利产品的过期速度。今后几年是药品专利到期的高峰,2012-2015年预计将有770亿美元销售的专利药到期全球仿制药市场的发展趋势全球仿制药市场发展迅速.在过去的十年中,市场增速是专利药的两倍以上.预计今年市场规模将超过1300亿美元。IMS预测未来五年内,仿制药保持10-14%的增速。仿制药在全球药品市场的比重从2000年的7%,提高到目前的15%,预计到2015年将超过20%。全球仿制药市场的发展趋势美国联邦立法(Hatch一Waxman法案)扶持仿制药产业,仿制药占全美处方药市场比例从2007年的63%上升到2008年年底的67%,是仿制药消费大国之首德国、英国的仿制药占本国处方药市场比例也已超过50%日本的仿制药市场从2007年的3062亿日元增至2010年的3597亿日元(40.3亿美元),增加17.5%中国制药企业的竞争优势生产能力强,化工产品品种丰富。原料药和中间体1350多个品种,原料药和制剂产能世界第一仿制能力强,各种化合物和制剂仿制能力强低成本,原材料、劳动力、环境、管理、成本中国制药企业的竞争劣势药物研发:投入资金不足,缺少有效的研发体系国际法规:内外法规差异大,存在技术壁垒国际营销:缺少对发达国家营销渠道的了解管理:质量管理不规范,缺少国际管理经验资金:药品国际注册、资本运营和市场开拓的资金需求较大中国仿制药行业发展的机遇中国仿制药未来发展的挑战与机遇研发的层级和阶段从1.1类品种受理情况看,我国仍然以第一,二层级的创新为主创新的层次主要处于以仿制为主到仿创结合阶段仿制药的水平和对公共健康的意义只有关注临床疗效一致的高水平仿制药可以解决发展中国家药品可及性问题,可以应对公共卫生需求低水平仿制或者仿标准的仿制不能很好的解决可及性问题,也无法满足公共卫生需求(一品两规)——未来的政策走向研究鼓励高水平仿制药的政策措施,引导仿制药的研发和生产水平提高中国仿制药产业针对不足的发展策略中国仿制药国际化发展路径原料药-----精细原料-----制剂国内市场-----国外市场低端产品-----高端产品贴牌产品-----自主品牌调整结构、产品升级、开发拓展国内市场的同时,紧盯国际市场药品注册管理法规环境对仿制药产业的引导药品管理法规体系TheLawsSystemofFoodandDrugAdministration中国食品药品管理法规体系药品管理法实施条例医疗器械监督管理条例麻醉药品和精神药品管理条例疫苗流通和预防接种管理条例中药保护条例药品监督行政处罚程序规定药物非临床试验质量管理规范药物临床试验管理规范药品进口管理办法药品经营许可证管理办法生物制品批签发管理办法医疗器械说明书、标签和包装标识管理规定药品生产监督管理办法医疗器械注册管理办法药品说明书和标签管理规定药品流通监督管理办法药品注册管理办法药品召回管理办法药品生产质量管理规范药品经营质量管理规范ProvisionandRequirementforDrugRegistration药品注册管理法规体系药品注册管理办法中药注册管理补充规定药品注册现场核查管理办法药品注册特殊审批程序管理规定药品技术转让注册管理规定新注册管理办法和配套文件发布后对仿制药发展的影响预期药用原辅材料备案管理规定-----DMF我国对原辅材料实施审批制度的问题药品制剂企业缺乏第一责任意识,对原辅材料质量审计的主动性不高,药用原辅材料使用只能主要依赖于其批准证明文件药品监督管理部门缺乏数据信息支持,监督检查不能溯源、监管效率不高药品监督管理部门、药品制剂生产企业和药用原辅材料生产企业责任不清,药品监督管理部门承担了企业应当承担的责任建立我国DMF制度的目标建立起符合我国国情的药用原辅材料备案管理制度为技术审评服务,提高对药用原辅材料审评水平和效率为现场检查和GMP检查服务,提高以品种为中心的检查水平,提高可控性和可追溯性为制...


 VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP VIP
VIP