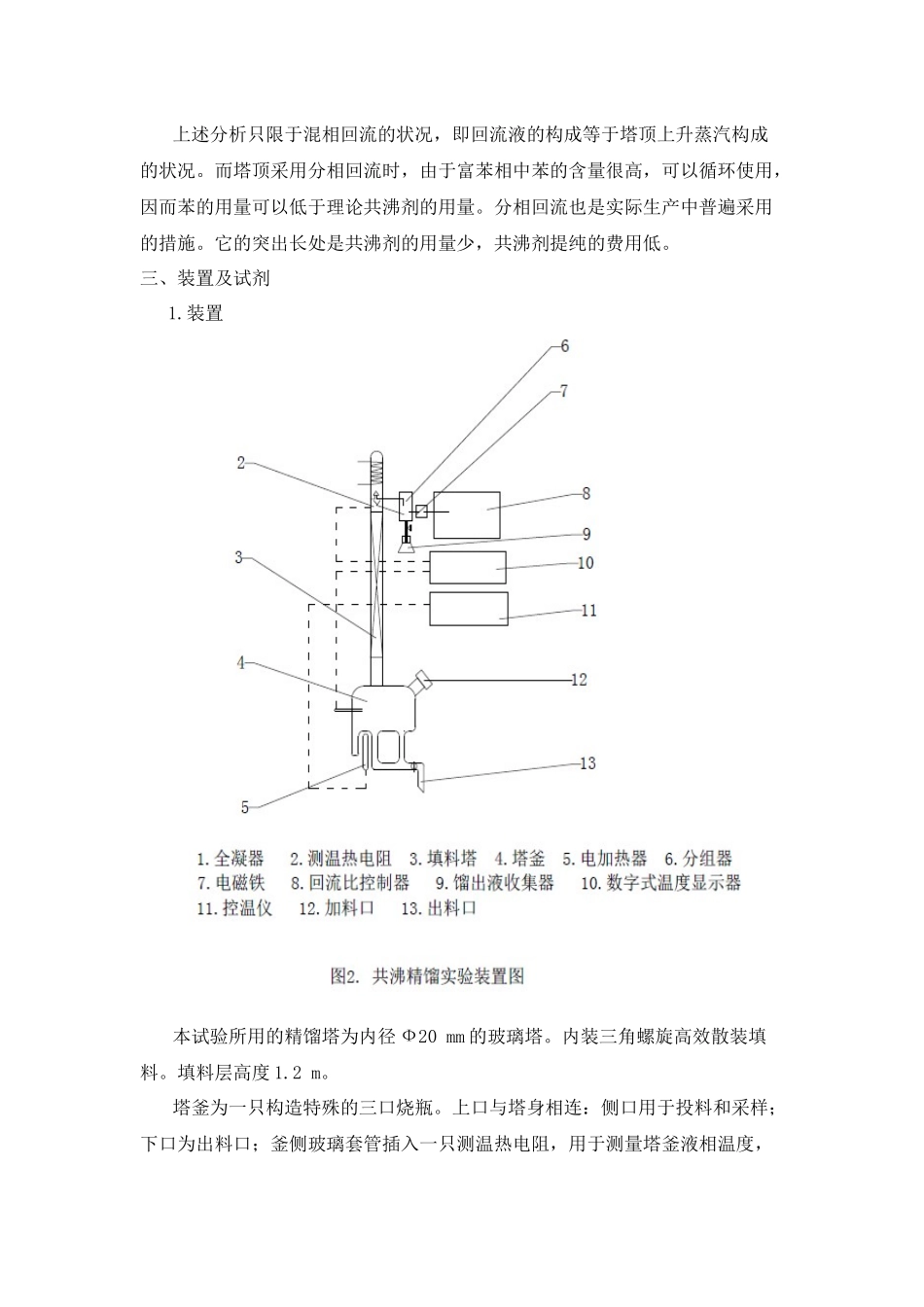
共沸精馏一、试验目的:1.通过试验加深对共沸精馏过程的理解。2.熟悉精馏设备的构造,掌握精馏操作措施。3.可以对精馏过程做全塔物料衡算。4.学会使用气相色谱分析气、液两相构成。二、试验原理:精馏是运用不一样组份在汽—液两相间的分派,通过多次汽液两相间的传质和传热来到达分离的目的。对于不一样的分离对象,精馏措施也会有所差异。例如,分离乙醇和水的二元物系。由于乙醇和水可以形成共沸物,并且常压下的共沸温度和乙醇的沸点温度极为相近,因此采用一般精馏措施只能得到乙醇和水的混合物,而无法得到无水乙醇。为此在乙醇—水体系中加入第三种物质,该物质被称为共沸剂。共沸剂具有能和被分离系统中的一种或几种物质形成最低共沸物的特性。在精馏过程中共沸剂将以共沸物的形式从塔顶蒸出,塔釜则得到无水乙醇。这种措施就称作共沸精馏。乙醇—水体系加入共沸剂苯后来可以形成四种共沸物。现将它们在常压下的共沸温度、共沸构成列于表1。为了便于比较,再将乙醇、水、苯三种纯物质常压下的沸点列于表2。表1乙醇水-苯三元共沸物性质共沸物(简记)共沸点/℃共沸物构成,t%乙醇水苯乙醇-水-苯(T)64.8518.57.474.1乙醇-苯(ABZ)68.2432.70.067.63苯-水(BWZ)69.250.08.8391.17乙醇-水(AWZ)78.1595.574.430.0表2乙醇、水、苯的常压沸点物质名称(简记)乙醇(A)水(W)苯(B)沸点温度(℃)78.310080.2从表1和表2列出沸点看,除乙醇-水二元共沸物的共沸物与乙醇沸点相近之外,其他三种共沸物的沸点与乙醇沸点均有10℃左右的温度差。因此,可以设法使水和苯以共沸物的方式从塔顶分离出来,塔釜则得到无水乙醇。整个精馏过程可以用图1来阐明。图中A、B、W分别为乙醇、苯和水的英文字头;ABZ,AWZ,BWZ代表三个二元共沸物,T表达三元共沸物。图中的曲线为25℃下的乙醇、水、苯三元共沸物的溶解度曲线。该曲线的下方为两相区,上方为均相区。图中标出的三元共沸构成点T是处在两相区内。以T为中心,连接三种纯物质A、B、W及三个二元共沸点构成点ABZ、AWZ、BWZ,将该图分为六个小三角形。假如原料液的构成点落在某个小三角形内。当塔顶采用混相回流时精馏的最终止果只能得到这个小三角形三个顶点所代表的物质。故要想得到无水乙醇,就应当保证原料液的构成落在包括顶点A的小三角形内,即在ΔATABZ或ΔATAWZ内。从沸点看,乙醇-水的共沸点和乙醇的沸点仅差0.15℃,就本试验的技术条件无法将其分开。而乙醇-苯的共沸点与乙醇的沸点相差10.06℃,很轻易将它们分离开来。因此分析的最终止果是将原料液的构成控制在ΔATABZ中。图1中F代表未加共沸剂时原料乙醇、水混合物的构成。伴随共沸剂苯的加入,原料液的总构成将沿着FB连线变化,并与AT线交于H点,这时共沸剂苯的加入量称作理论共沸剂用量,它是到达分离目的所需至少的共沸剂量。上述分析只限于混相回流的状况,即回流液的构成等于塔顶上升蒸汽构成的状况。而塔顶采用分相回流时,由于富苯相中苯的含量很高,可以循环使用,因而苯的用量可以低于理论共沸剂的用量。分相回流也是实际生产中普遍采用的措施。它的突出长处是共沸剂的用量少,共沸剂提纯的费用低。三、装置及试剂1.装置本试验所用的精馏塔为内径Ф20mm的玻璃塔。内装三角螺旋高效散装填料。填料层高度1.2m。塔釜为一只构造特殊的三口烧瓶。上口与塔身相连:侧口用于投料和采样;下口为出料口;釜侧玻璃套管插入一只测温热电阻,用于测量塔釜液相温度,釜底玻璃套管装有电加热棒,采用电加热,加热釜料,并通过一台自动控温仪控制加热温度,使塔釜的传热量基本保持不变。塔釜加热沸腾后产生的蒸汽经填料层抵达塔顶全凝器。为了满足多种不一样操作方式的需要,在全凝器与回流管之间设置了一种特殊构造的容器。在进行分相回流时,它可以用作分相器兼回流比调整器;当进行混相回流时,它又可以单纯地作为回流比调整器使用。这样的设计既实现了持续精馏操作,又可进行间歇精馏操作。此外,需要尤其阐明的是在进行分相回流时,分相器中会出现两层液体。上层为富苯相、下层为富水相。试验中,富苯相由溢流口回流入塔,富水相则采出。当间歇操作时,为了保证有足够高...