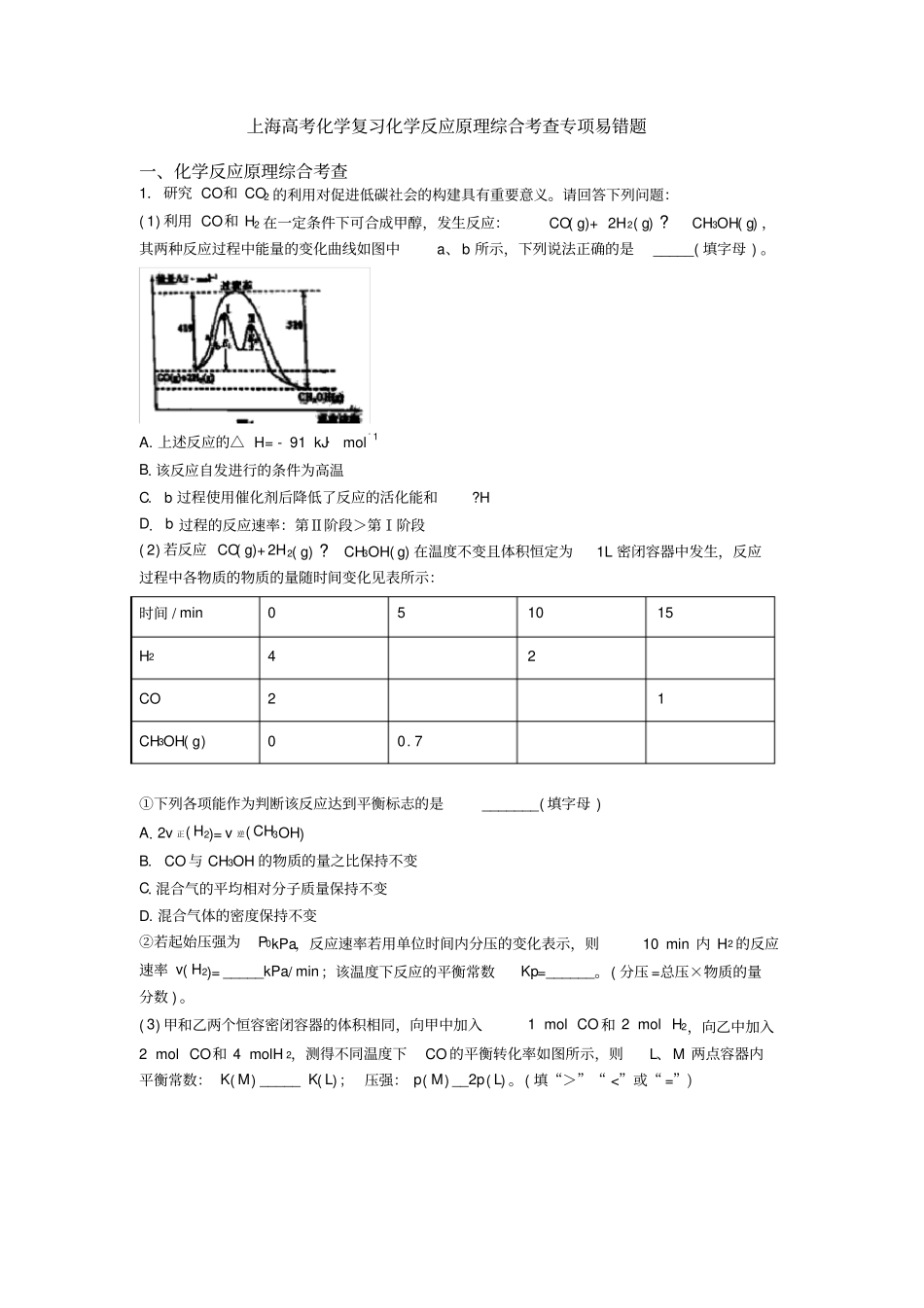
上海高考化学复习化学反应原理综合考查专项易错题一、化学反应原理综合考查1.研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:(1)利用CO和H2在一定条件下可合成甲醇,发生反应:CO(g)+2H2(g)?CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。A.上述反应的△H=-91kJ·mol-1B.该反应自发进行的条件为高温C.b过程使用催化剂后降低了反应的活化能和?HD.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段(2)若反应CO(g)+2H2(g)?CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:时间/min051015H242CO21CH3OH(g)00.7①下列各项能作为判断该反应达到平衡标志的是_______(填字母)A.2v正(H2)=v逆(CH3OH)B.CO与CH3OH的物质的量之比保持不变C.混合气的平均相对分子质量保持不变D.混合气体的密度保持不变②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____K(L);压强:p(M)__2p(L)。(填“>”“<”或“=”)(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯()。电解时,阴极的电极反应式是_________。【答案】ADBC030P209PkPa-2(可不带单位)<>2nCO2+12ne-+12nH+=+4nH2O【解析】【分析】【详解】(1)A.对于反应CO(g)+2H2(g)?CH3OH(g),根据反应过程中能量的变化图可得△H=正反应的活化能-逆反应的活化能=419kJ·mol-1-510kJ·mol-1=-91kJ·mol-1,A项正确;B.该反应正向是气体粒子数目减小的反应,属于熵减过程△S<0,根据△G=△H-T△S,△G<0可自发,需要低温环境才可以自发,B项错误;C.b过程使用催化剂后降低了反应的活化能,但是?H只与反应始末状态有关,与反应途径无关,?H故不变,C项错误;D.b过程中第I阶段正反应活化能较高,故活化分子的百分含量较低,因此化学反应速率较慢,b过程的反应速率:第I阶段<第Ⅱ阶段,D项正确。故说法正确的选AD。(2)①A.对于反应CO(g)+2H2(g)?CH3OH(g),当v正(H2)=2v逆(CH3OH)时,反应到达平衡,2v正(H2)=v逆(CH3OH),正逆反应各物质速率不成比例,未达到平衡,故A项错误;B.反应物CO与生成物CH3OH的物质的量之比从开始反应逐渐减小,若保持不变可以说明达到平衡,B项正确;C.混合气的平均相对分子质量数值上等于摩尔质量M=mn,因为质量守恒m不变,该反应正向是气体粒子数目较小方向,n会减小,M会增大,达到平衡之后M不变,故C项正确;D.混合气体的密度=mV,m不变容器体积固定,则混合气体的密度是个定值,一直不变,不能做平衡的判定依据,D项错误;故能作为判断该反应达到平衡标志的是BC;②同温1L容器中,气体的物质的量与压强呈正比,初始加入2molCO和4molH2,混合气体共6mol,起始压强为P0kPa,则起始氢气的分压23P0kPa,反应10minH2的物质的量为2mol,是原来氢气物质的量的一半,反应10minH2的分压13P0kPa,故10min内H2的反应速率v(H2)=2tPH=0010min2133PkPaPkPa=030PkPa/min;反应10minH2的物质的量为2mol,CO的物质的量为1mol,生成的甲醇为1mol,混合气体共4mol,那么H2的物质的量分数0.5,CO和甲醇的物质的量分数均为0.25。反应15min和反应10min数据一样,故10min已经达到平衡。由于气体的物质的量与压强呈正比,故0PP平=0nn平=32,得P平=230PkPa,则平衡时H2的分压P2H=0.5×230P=130PkPa,同理PCO=P3CHOH=0.25×230P=160PkPa,该温度下平衡常数Kp=322P(CHOH)P(CO)P(H)g=0200161163PkPaPkPaPkPa=209PkPa-2;(3)根据CO的平衡转化率-T-P图分析,其他条件不变(观察甲或者乙),升高温度,CO的平衡转化率降低,根据平衡移动原理该可逆反应的正反应是放热的,则K值随温度升高而降低,由于甲和在在温度不变的时候平衡常数是相同的,故L、M两点容器内平衡常数:K(M)<K(L);向甲中加入...