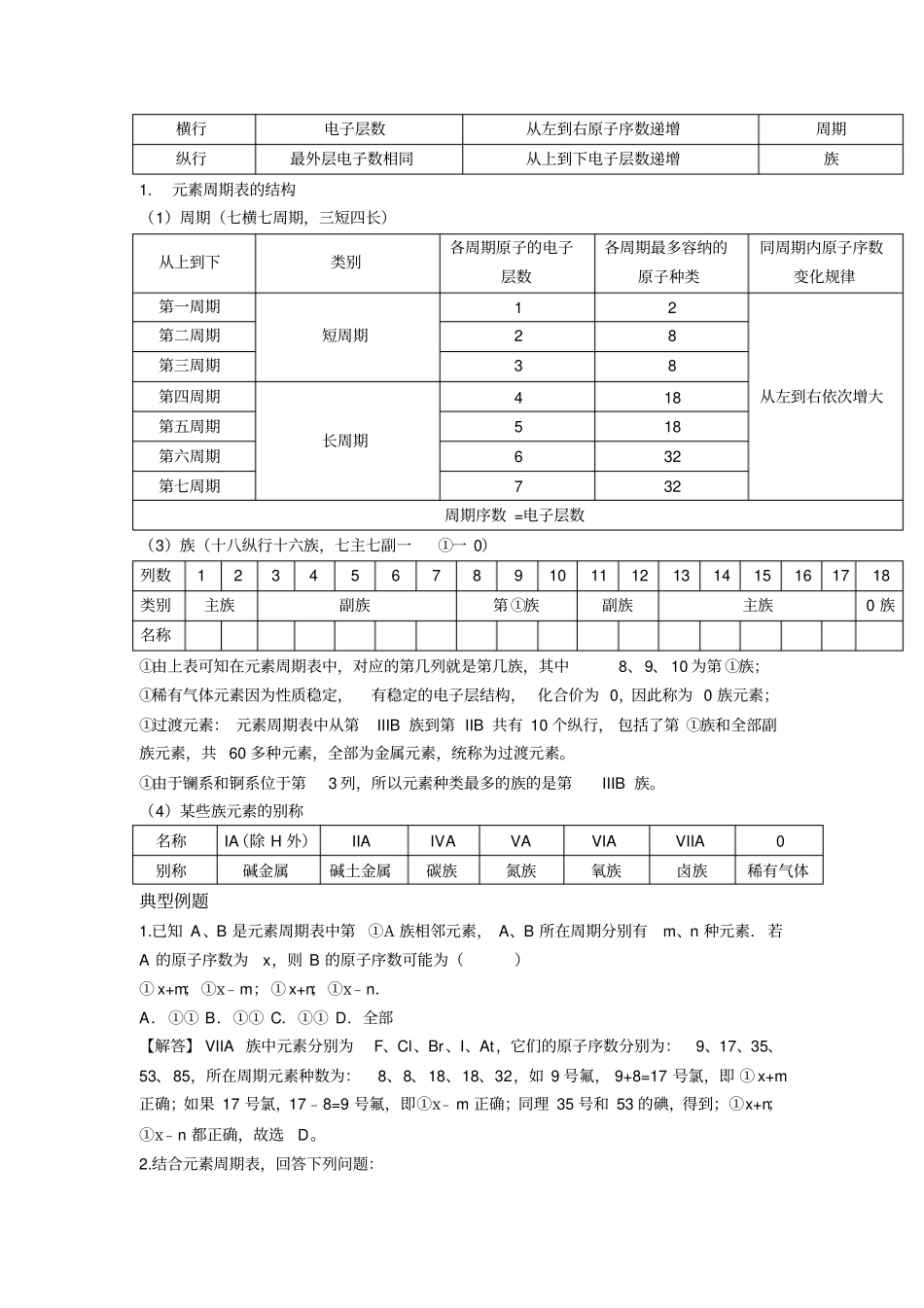
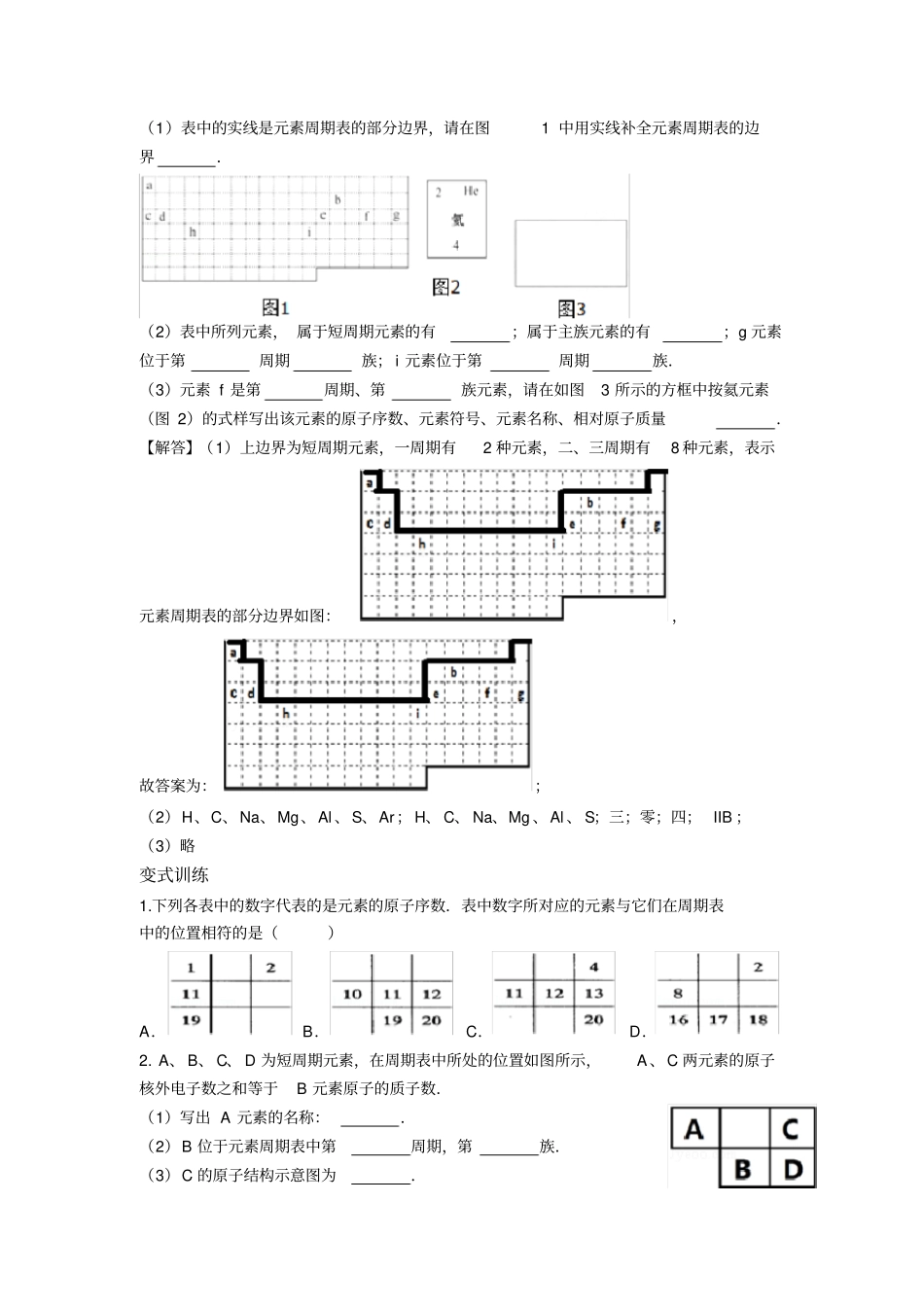
第一讲元素周期表【展示目标聚焦学习】1、原子结构2、元素周期表3、碱金属元素及其性质4、卤族元素及其性质【知识精讲深化思维】要点一:原子结构1、元素周期表的诞生及其发展诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表;依据:将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行;意义:揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑;发展:随着化学科学的不断发展,元素周期表中为未知元素留下空位先后被排满;成熟:当原子结构的奥秘被发现后,元素周期表中的元素的排列依据由相对原子质量改为原子的原子序数,形成现行的元素周期表。2、元素周期表的编排原则(1)原子与元素的关系①原子的结构原子的结构在一个原子中:核电荷数=质子数=核外电子数=原子序数①元素的定义:质子数相同的一类原子的总称;关系:元素将原子分类,按照质子数是否相同分类,对应的一类原子就是一种元素。原子序数与元素的原子结构之间的关系:原子序数=核外电子数=质子数=核电荷数。(2)原子核外电子排布的规律核外电子遵循“2n2”的规律:其中“2n2”指的是每一层最多容纳的电子数;“n”指的是电子层数。每一层排满是最稳定的结构,每当排下那一层电子的时候,首先要看看能不能排满,如果不能排满,则以上一层为标准来排,然后依次类推。(3)编排原则相同点递增名称一个单位的负电荷)核外电子(一个电子带中子(不带电)电荷)个质子带一个单位的正质子(原子核(带正电)1横行电子层数从左到右原子序数递增周期纵行最外层电子数相同从上到下电子层数递增族1.元素周期表的结构(1)周期(七横七周期,三短四长)从上到下类别各周期原子的电子层数各周期最多容纳的原子种类同周期内原子序数变化规律第一周期短周期12从左到右依次增大第二周期28第三周期38第四周期长周期418第五周期518第六周期632第七周期732周期序数=电子层数(3)族(十八纵行十六族,七主七副一①一0)列数123456789101112131415161718类别主族副族第①族副族主族0族名称①由上表可知在元素周期表中,对应的第几列就是第几族,其中8、9、10为第①族;①稀有气体元素因为性质稳定,有稳定的电子层结构,化合价为0,因此称为0族元素;①过渡元素:元素周期表中从第IIIB族到第IIB共有10个纵行,包括了第①族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。①由于镧系和锕系位于第3列,所以元素种类最多的族的是第IIIB族。(4)某些族元素的别称名称IA(除H外)IIAIVAVAVIAVIIA0别称碱金属碱土金属碳族氮族氧族卤族稀有气体典型例题1.已知A、B是元素周期表中第①A族相邻元素,A、B所在周期分别有m、n种元素.若A的原子序数为x,则B的原子序数可能为()①x+m;①x﹣m;①x+n;①x﹣n.A.①①B.①①C.①①D.全部【解答】VIIA族中元素分别为F、Cl、Br、I、At,它们的原子序数分别为:9、17、35、53、85,所在周期元素种数为:8、8、18、18、32,如9号氟,9+8=17号氯,即①x+m正确;如果17号氯,17﹣8=9号氟,即①x﹣m正确;同理35号和53的碘,得到;①x+n;①x﹣n都正确,故选D。2.结合元素周期表,回答下列问题:(1)表中的实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界.(2)表中所列元素,属于短周期元素的有;属于主族元素的有;g元素位于第周期族;i元素位于第周期族.(3)元素f是第周期、第族元素,请在如图3所示的方框中按氦元素(图2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量.【解答】(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图:,故答案为:;(2)H、C、Na、Mg、Al、S、Ar;H、C、Na、Mg、Al、S;三;零;四;IIB;(3)略变式训练1.下列各表中的数字代表的是元素的原子序数.表中数字所对应的元素与它们在周期表中的位置相符的是()A.B.C.D.2.A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B元素原子的质子数.(1)写出A元素的名称:.(2)B位于元素周期表中第周期,第族.(3)...