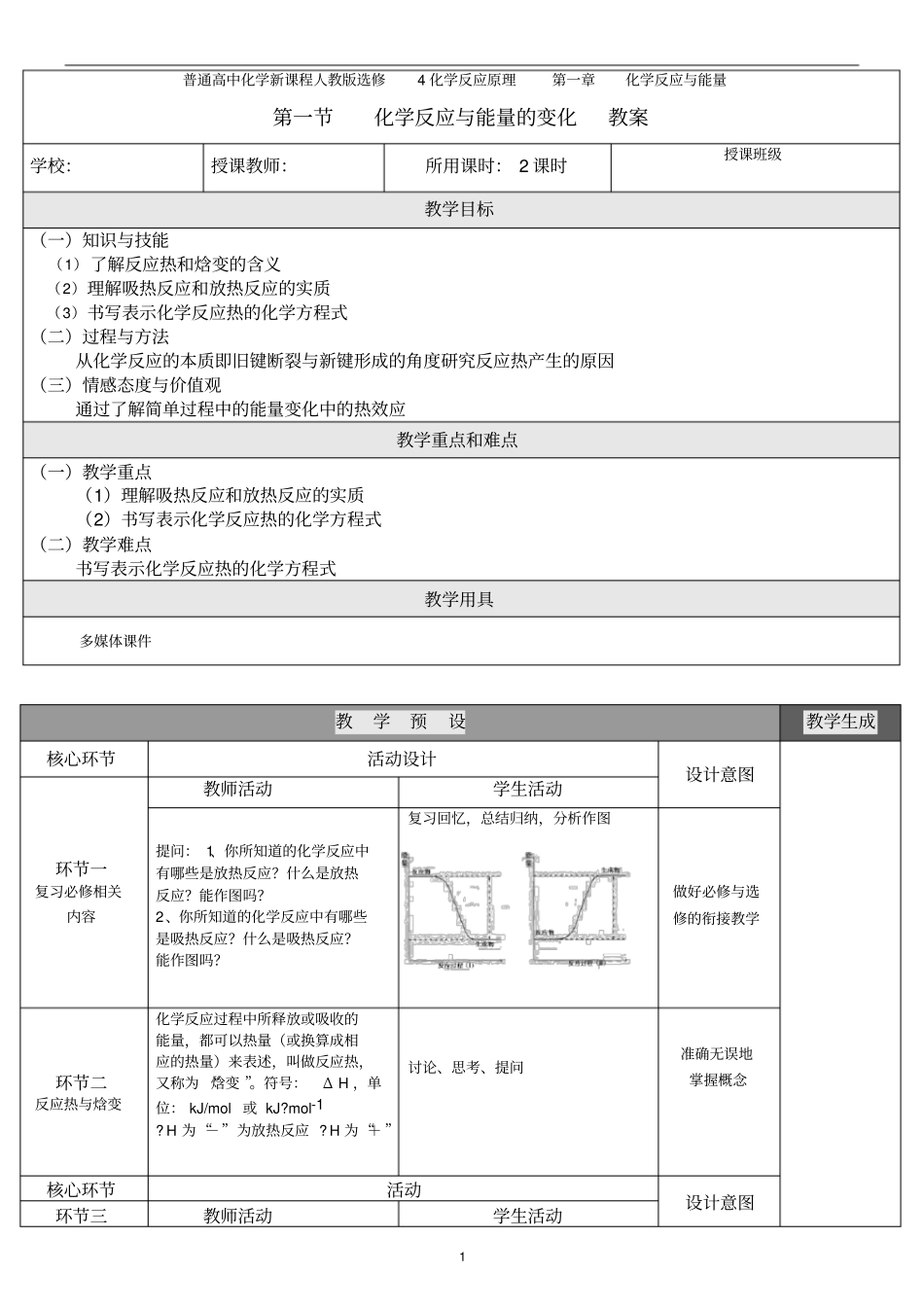
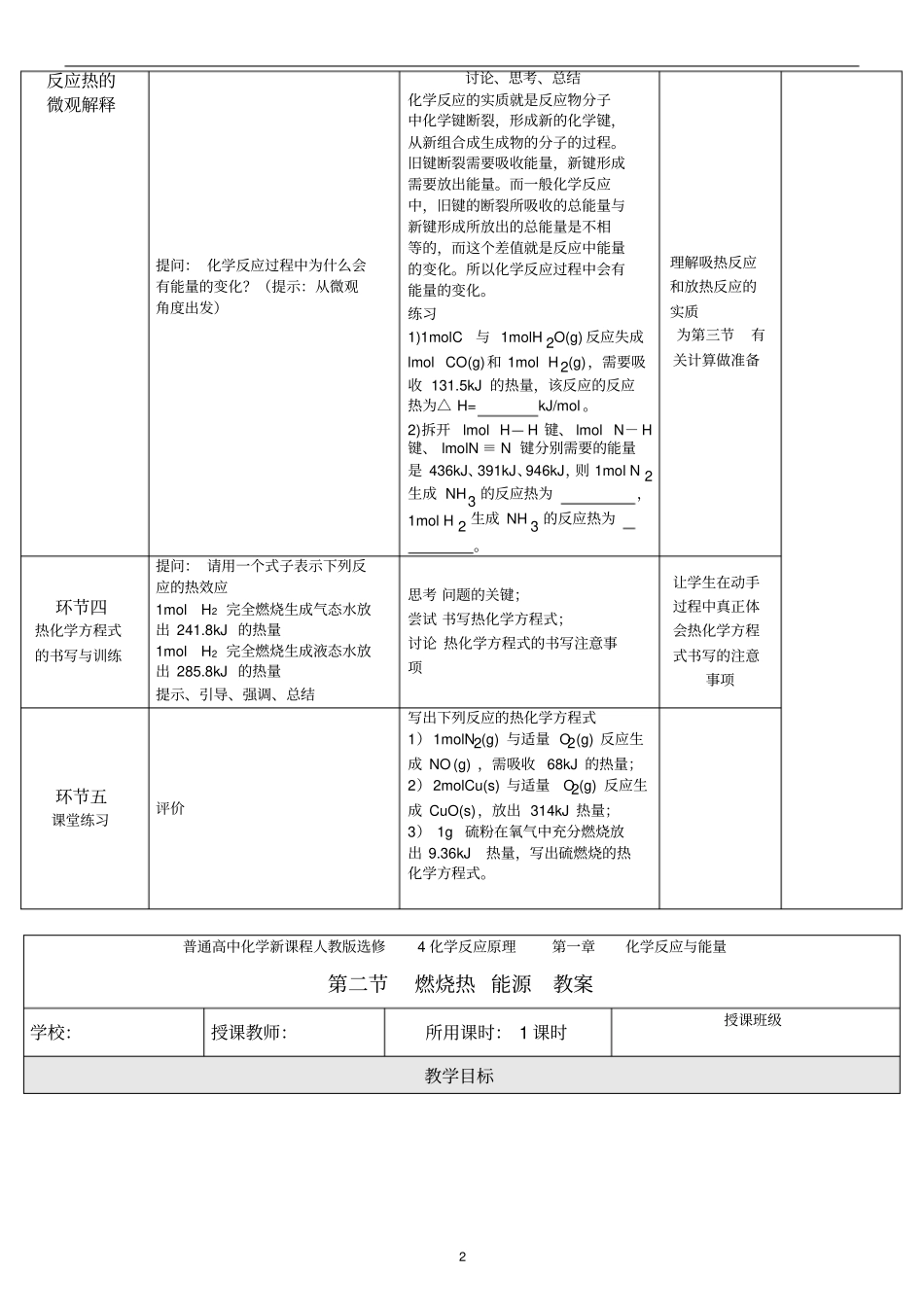
1普通高中化学新课程人教版选修4化学反应原理第一章化学反应与能量第一节化学反应与能量的变化教案学校:授课教师:所用课时:2课时授课班级教学目标(一)知识与技能(1)了解反应热和焓变的含义(2)理解吸热反应和放热反应的实质(3)书写表示化学反应热的化学方程式(二)过程与方法从化学反应的本质即旧键断裂与新键形成的角度研究反应热产生的原因(三)情感态度与价值观通过了解简单过程中的能量变化中的热效应教学重点和难点(一)教学重点(1)理解吸热反应和放热反应的实质(2)书写表示化学反应热的化学方程式(二)教学难点书写表示化学反应热的化学方程式教学用具多媒体课件教学预设教学生成核心环节活动设计设计意图环节一复习必修相关内容教师活动学生活动提问:1、你所知道的化学反应中有哪些是放热反应?什么是放热反应?能作图吗?2、你所知道的化学反应中有哪些是吸热反应?什么是吸热反应?能作图吗?复习回忆,总结归纳,分析作图做好必修与选修的衔接教学环节二反应热与焓变化学反应过程中所释放或吸收的能量,都可以热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”。符号:ΔH,单位:kJ/mol或kJ?mol-1?H为“-”为放热反应?H为“+”讨论、思考、提问准确无误地掌握概念核心环节活动设计意图环节三教师活动学生活动2反应热的微观解释提问:化学反应过程中为什么会有能量的变化?(提示:从微观角度出发)讨论、思考、总结化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,从新组合成生成物的分子的过程。旧键断裂需要吸收能量,新键形成需要放出能量。而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中会有能量的变化。练习1)1molC与1molH2O(g)反应失成lmolCO(g)和1molH2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=kJ/mol。2)拆开lmolH—H键、lmolN-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2生成NH3的反应热为,1molH2生成NH3的反应热为。理解吸热反应和放热反应的实质为第三节有关计算做准备环节四热化学方程式的书写与训练提问:请用一个式子表示下列反应的热效应1molH2完全燃烧生成气态水放出241.8kJ的热量1molH2完全燃烧生成液态水放出285.8kJ的热量提示、引导、强调、总结思考问题的关键;尝试书写热化学方程式;讨论热化学方程式的书写注意事项让学生在动手过程中真正体会热化学方程式书写的注意事项环节五课堂练习评价写出下列反应的热化学方程式1)1molN2(g)与适量O2(g)反应生成NO(g),需吸收68kJ的热量;2)2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量;3)1g硫粉在氧气中充分燃烧放出9.36kJ热量,写出硫燃烧的热化学方程式。普通高中化学新课程人教版选修4化学反应原理第一章化学反应与能量第二节燃烧热能源教案学校:授课教师:所用课时:1课时授课班级教学目标3(一)知识与技能(1)理解燃烧燃烧的含义(2)掌握表示燃烧热的热化学方程式的写法和有关燃烧热的简单的计算(二)过程与方法通过对“应根据什么标准来选择燃料”的教学,让学生学会多角度的综合分析的方法(三)情感态度与价值观通过结我国的能源现状的认识过程,培养学生的节能意识教学重点和难点(一)教学重点表示燃烧热的热化学方程式的写法和有关燃烧热的简单的计算(二)教学难点表示燃烧热的热化学方程式的写法教学预设教学生成核心环节活动设计设计意图环节一燃烧热的概念教师活动学生活动指导学生阅读相关教材内容强调燃烧热概念的几个关键词认真阅读教材,总结燃烧热概念准确无误掌握概念的内涵和外延环节二燃烧热的有关练习讲解、分析[练习1]分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?A.C(s)+O2(g)===CO(g);ΔH=110.5kJ/molB.C(s)+O2(g)===CO2(g);ΔH=-393.5kJ/molC.2H2(g)+O2(g)==2H2O(l);ΔH=-571.6kJ/molD.H2(g)+1/2O2(g)==H2O(g);ΔH=-241.8kJ/mol巩固相关概念核心环节活动设计意图环节三中和热的概念教师活动学生活动指导学生阅读相关教材内容强调中...