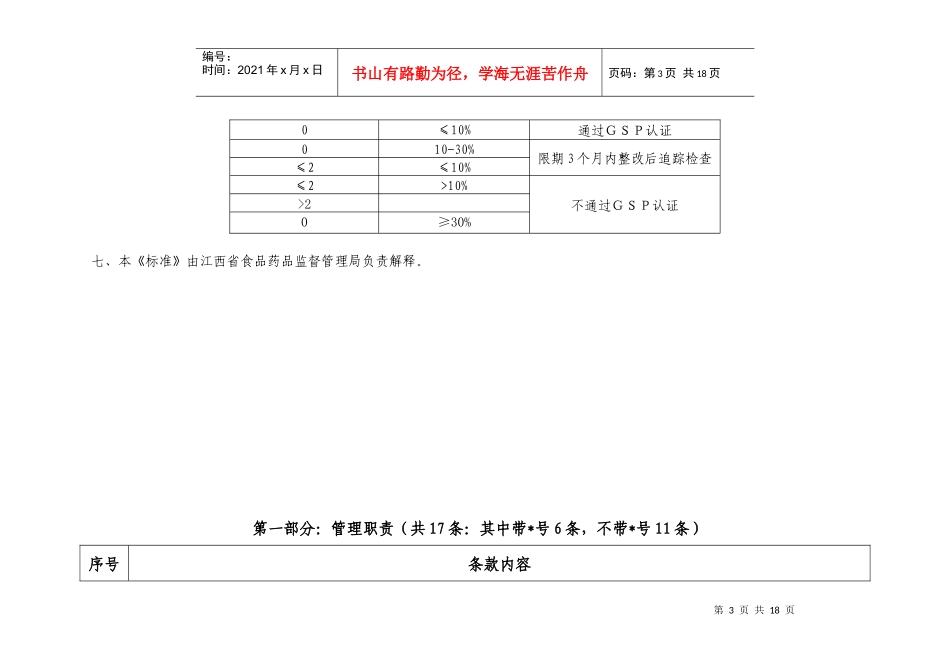
第1页共18页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第1页共18页江西省体外诊断试剂经营企业(批发)GSP认证检查评定标准江西省食品药品监督管理局制二○○七年十二月第2页共18页第1页共18页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第2页共18页编制说明一、为规范本省体外诊断试剂经营企业(批发)的GSP认证检查,统一检查标准,根据国家食品药品监督管理局《关于印发体外诊断试剂经营企业(批发)验收标准和开办申请程序的通知》、《药品经营许可证管理办法》、《药品经营质量管理规范》(2007.7.1)、《药品经营质量管理规范实施细则》、《药品批发企业GSP认证检查评定标准》及《江西省体外诊断试剂经营企业(批发)验收标准细则》,特制定《江西省体外诊断试剂经营企业(批发)GSP认证检查评定标准》(以下简称《标准》)。二、本《标准》适用于江西省辖区内药品类体外诊断试剂经营企业(批发)的GSP认证检查。三、本《标准》分八个部分:一、管理职责;二、人员与培训;三、设施与设备;四、进货;五、验收;六、储存与养护;七、出库与运输;八、销售与售后服务。四、本标准共96项,其中关键条款(条款前加“*”)34项,一般条款62项。五、现场检查认证时,检查组应对本标准所列项目及其涵盖的内容进行全面检查,并逐项作出考核评定。凡全部达到项目内容规定要求的,评定为合格项目;项目内容不完整、不齐全的,评定为不合格项目。关键项目不合格为严重缺陷,一般项目不合格为一般缺陷。一般缺陷项数缺陷率=一般项目总数六、结果评定:项目结果严重缺陷一般缺陷第3页共18页第2页共18页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第3页共18页0≤10%通过GSP认证010-30%限期3个月内整改后追踪检查≤2≤10%≤2>10%不通过GSP认证>20≥30%七、本《标准》由江西省食品药品监督管理局负责解释。第一部分:管理职责(共17条:其中带*号6条,不带*号11条)序号条款内容第4页共18页第3页共18页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第4页共18页*0401企业应按照依法批准的经营方式和经营范围,从事体外诊断试剂经营活动。0501企业应建立以主要负责人为首,包括进货、销售、储运等业务部门负责人和企业质量管理机构负责人在内的质量领导组织。0502企业质量领导组织的主要职责是:建立企业的质量体系,实施企业质量方针,保证企业质量管理工作人员行使职权。*0601企业应设置专门的质量管理机构,机构下设质量管理组(员)、质量验收组(员)。0602企业质量管理机构应行使质量管理职能,在企业内部对体外诊断试剂质量具有裁决权。0603企业质量管理机构应负责起草企业体外诊断试剂质量管理制度,并指导、督促制度的执行。0604企业质量管理机构应负责首营企业和首营品种的质量审核。0605企业质量管理机构应负责建立企业所经营体外诊断试剂并包括质量标准等内容的质量档案。*0606企业质量管理机构应负责体外诊断试剂质量的查询和体外诊断试剂质量事故或质量投诉的调查、处理及报告。0607企业质量管理机构应负责体外诊断试剂的验收。0608企业质量管理机构应负责指导和监督体外诊断试剂保管、养护和运输中的质量工作。0609企业质量管理机构应负责质量不合格体外诊断试剂的审核,对处理过程实施监督。0610企业质量管理机构应负责收集和分析体外诊断试剂质量信息。*0701企业应设置与经营规模相适应的体外诊断试剂验收、养护等组织或人员。企业体外诊断试剂养护组或养护员在业务上应接受质量管理机构的监督指导。第5页共18页第4页共18页编号:时间:2021年x月x日书山有路勤为径,学海无涯苦作舟页码:第5页共18页*0801企业制定的制度应包括质量方针和目标管理;质量体系审核;质量责任;质量管理文件管理;内部评审规定;质量否决权规定;体外诊断试剂有效期管理;体外诊断试剂购进、验收、储存、养护、销售、出库、运输、售后服务的管理;不合格体外诊断试剂的管理;退货体外诊断试剂管理;设施设备管理;人员健康状况管理;计算机信息化管理;人员培训管理制度;投诉管理制度;体外诊断试剂产品索证...