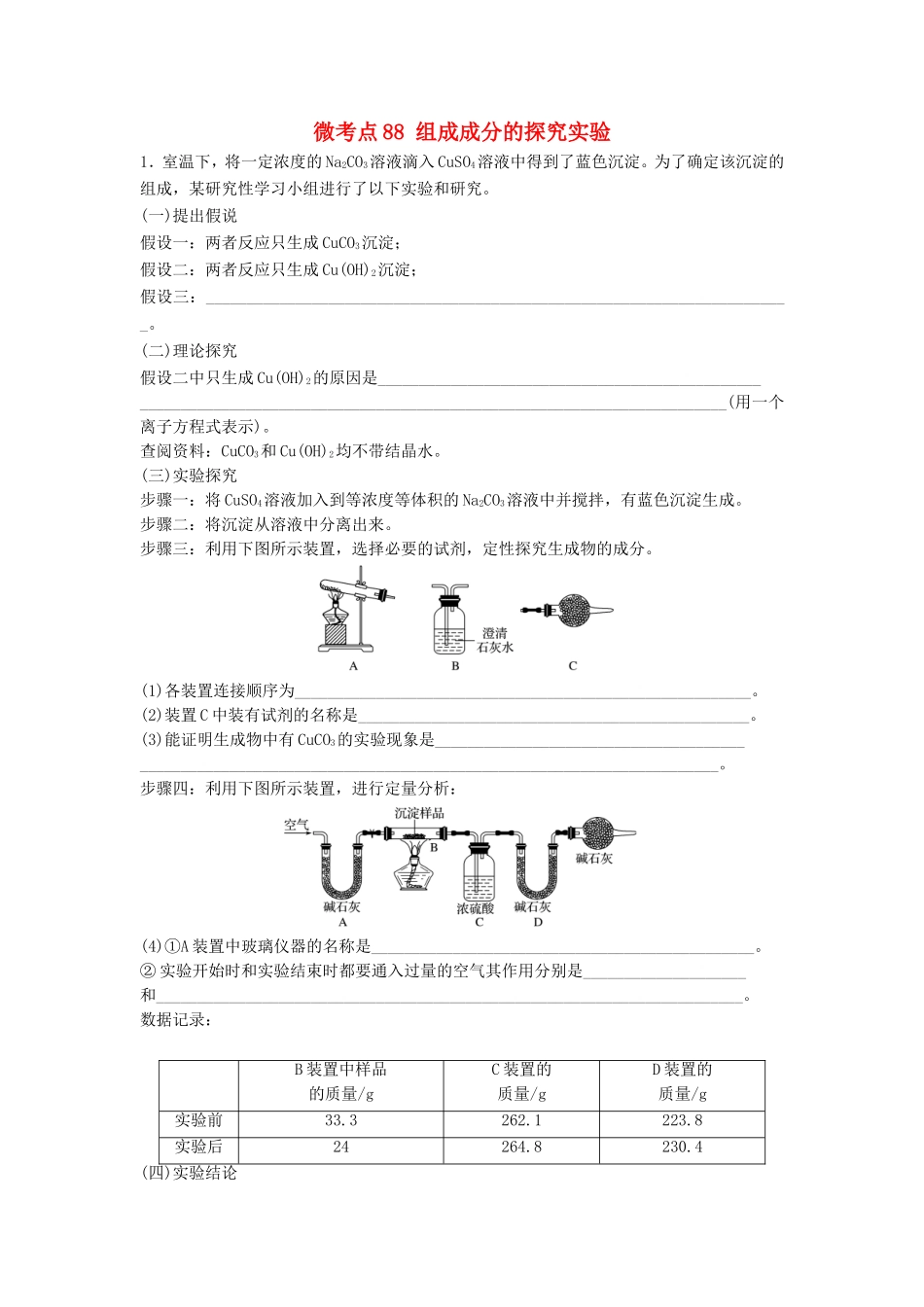
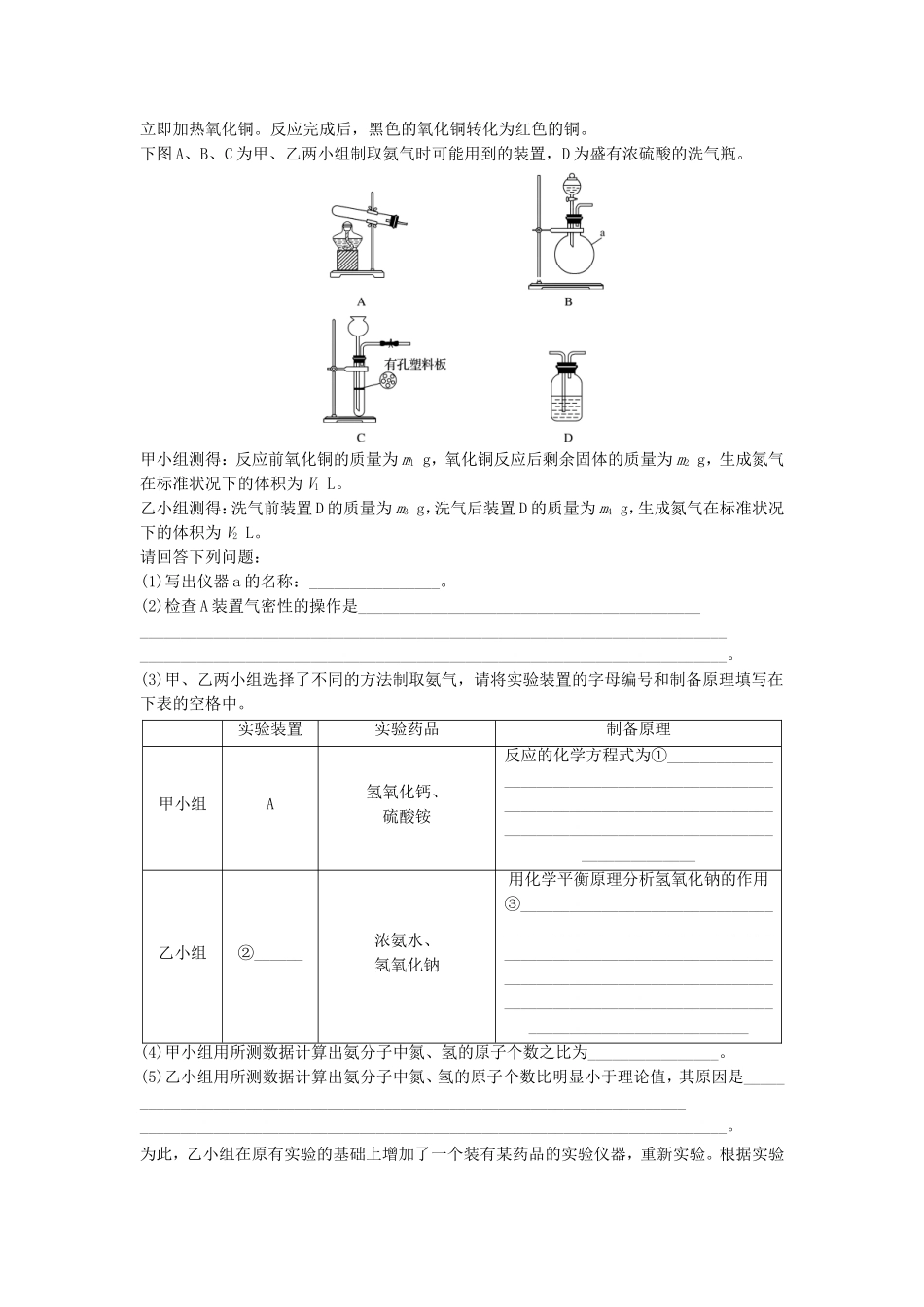
微考点88组成成分的探究实验1.室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定该沉淀的组成,某研究性学习小组进行了以下实验和研究。(一)提出假说假设一:两者反应只生成CuCO3沉淀;假设二:两者反应只生成Cu(OH)2沉淀;假设三:________________________________________________________________________。(二)理论探究假设二中只生成Cu(OH)2的原因是_______________________________________________________________________________________________________________________(用一个离子方程式表示)。查阅资料:CuCO3和Cu(OH)2均不带结晶水。(三)实验探究步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。步骤二:将沉淀从溶液中分离出来。步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。(1)各装置连接顺序为________________________________________________________。(2)装置C中装有试剂的名称是________________________________________________。(3)能证明生成物中有CuCO3的实验现象是_____________________________________________________________________________________________________________。步骤四:利用下图所示装置,进行定量分析:(4)①A装置中玻璃仪器的名称是_______________________________________________。②实验开始时和实验结束时都要通入过量的空气其作用分别是____________________和________________________________________________________________________。数据记录:B装置中样品的质量/gC装置的质量/gD装置的质量/g实验前33.3262.1223.8实验后24264.8230.4(四)实验结论利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式。2.王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:(1)甲同学认为该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式:________________________________________________________________________________________________________________________________________________。(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是________________________________________________________________________________________________________________________________________________。(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:假设一:氯水有强氧化性,将溶液中的SCN-氧化;假设二:空气中有还原性物质,将________________________________________________;假设三:氯水有极强的氧化性,将__________________________________________;基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1硝酸、1.0mol·L-1盐酸、1.0mol·L-1NaOH溶液、0.1mol·L-1FeCl3溶液、0.1mol·L-1CuSO4溶液、20%KSCN、蒸馏水。实验操作预期现象结论取少量褪色后的溶液,__________________说明假设一是合理的(4)乙同学用酒精灯加热做“铁与水蒸气反应”的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为__________________________________________________________________________________________________________________________。3.甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计了如下实验流程:实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完成后,黑色的氧化铜转化为红色的铜。下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。甲小组测得:反应前氧化铜的质量为m1g,氧化铜反应后剩余固体的质量为m2g,生成氮气在标准状况下的体积为V1L。乙小组测得:洗气前装置D的质量为m3g,洗气后装置D的质量为m4g,生成氮气在标准状况下...