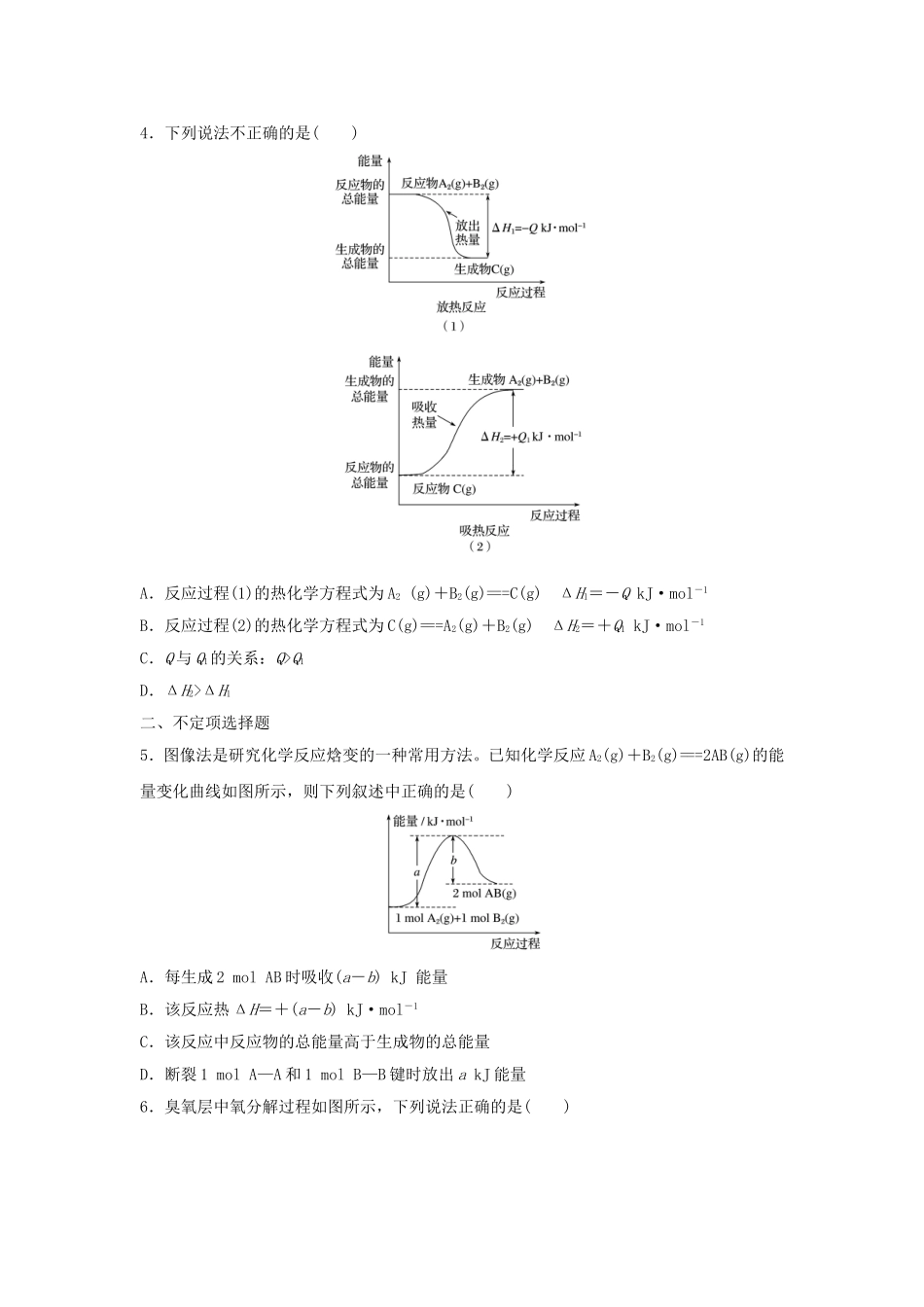
微考点43能量图像一、单项选择题1.化学反应A2+B2===2AB的能量变化如下图所示,则下列说法中正确的是()A.该反应是吸热反应B.断裂1molA—A键和1molB—B键时能放出xkJ的能量C.断裂2molA—B键时需要吸收ykJ的能量D.2molAB的总能量高于1molA2和1molB2的总能量2.反应物X转化为Y和Z的能量变化如图所示,下列说法正确的是()A.由X→Y反应的ΔH=E5-E2B.由X→Z反应的ΔH>0C.由图可知等物质的量的Y的能量一定比X的能量高D.升高温度可提高X→Z的反应速率3.单斜硫和正交硫转化为二氧化硫的能量变化如下图所示。下列说法正确的是()A.S(单斜,s)===S(正交,s)ΔH=+0.33kJ·mol-1B.正交硫比单斜硫稳定C.相同物质的量的正交硫比单斜硫所含有的能量高D.①表示断裂1molO2中的共价键所吸收的能量比形成1molSO2中的共价键所放出的能量少297.16kJ4.下列说法不正确的是()A.反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g)ΔH1=-QkJ·mol-1B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g)ΔH2=+Q1kJ·mol-1C.Q与Q1的关系:Q>Q1D.ΔH2>ΔH1二、不定项选择题5.图像法是研究化学反应焓变的一种常用方法。已知化学反应A2(g)+B2(g)===2AB(g)的能量变化曲线如图所示,则下列叙述中正确的是()A.每生成2molAB时吸收(a-b)kJ能量B.该反应热ΔH=+(a-b)kJ·mol-1C.该反应中反应物的总能量高于生成物的总能量D.断裂1molA—A和1molB—B键时放出akJ能量6.臭氧层中氧分解过程如图所示,下列说法正确的是()A.催化反应①②均为放热反应B.催化剂不能改变该反应的焓变C.ClO是该反应的催化剂D.在该反应过程中没有化学键的断裂与生成三、非选择题7.金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。(1)在通常状况下,金刚石和石墨相比较,____________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为________________。(2)12g石墨在一定量的空气中燃烧,生成气体36g,该过程放出的热量为____________。8.NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。(1)已知:2NO2(g)N2O4(g)ΔH12NO2(g)N2O4(l)ΔH2下列能量变化示意图中正确的是________(选填字母)。(2)N2O4与O2、H2O化合的化学方程式是___________________________________________________________________________________________________________。答案精析1.C[由图示可知:1molA2和1molB2的总能量高于2molAB的总能量,该反应为放热反应,A、D错误;断裂化学键时需要吸收能量,B错、C正确。]2.D[由X→Y反应的ΔH=E3-E2,A错误;由X→Z反应的ΔH=E1-E2<0,B错误;物质能量的高低还与物质所处的状态有关,C错误;温度升高化学反应速率加快,D正确。]3.B[根据盖斯定律,得:S(单斜,s)===S(正交,s)ΔH=-0.33kJ·mol-1,可知单斜硫转化为正交硫时要放出热量,正交硫的能量要低,较稳定,故A项错误、B项正确;相同物质的量的正交硫比单斜硫所含有的能量低,C项错误;①表示断裂1molS(单斜,s)和1molO2(g)中的共价键所吸收的能量比形成1molSO2(g)中的共价键所放出的能量少297.16kJ,D项错误。]4.C[Q与Q1的关系应为Q=Q1。]5.AB[依据图像分析,1molA2和1molB2反应生成2molAB,吸收(a-b)kJ能量,A正确;ΔH=反应物能量总和-生成物能量总和,反应热ΔH=+(a-b)kJ·mol-1,B正确;反应物的总能量低于生成物的总能量,C错误;断裂键时要吸收能量,D错误。]6.B7.(1)石墨393.5kJ·mol-1(2)252.0kJ解析(1)由图知,石墨具有的能量比金刚石的低,而物质所具有的能量越低越稳定,故石墨更稳定。计算燃烧热时,要求燃烧产物处于稳定状态,即C应生成CO2气体,故石墨的燃烧热为110.5kJ·mol-1+283.0kJ·mol-1=393.5kJ·mol-1。(2)12g石墨在一定量的空气中燃烧,生成气体36g,此气体应为CO和CO2的混合气体。设生成CO的物质的量为x,则CO2的物质的量为(1mol-x),故有28g·mol-1×x+44g·mol-1×(1mol-x)=36g,解得x=0.5mol。因此该过程放出的热量为110.5kJ·mol-1×0.5mol+393.5kJ·mol-1×0.5mol=252.0kJ。8.(1)A(2)2N2O4+O2+2H2O===4HNO3解析(1)等质量的N2O4(g)具有的能量高于N2O4(l),因此等量的NO2(g)生成N2O4(l)放出的热量多,只有A项符合题意。(2)N2O4与O2、H2O发生化合反应生成HNO3,化学方程式为2N2O4+O2+2H2O===4HNO3。