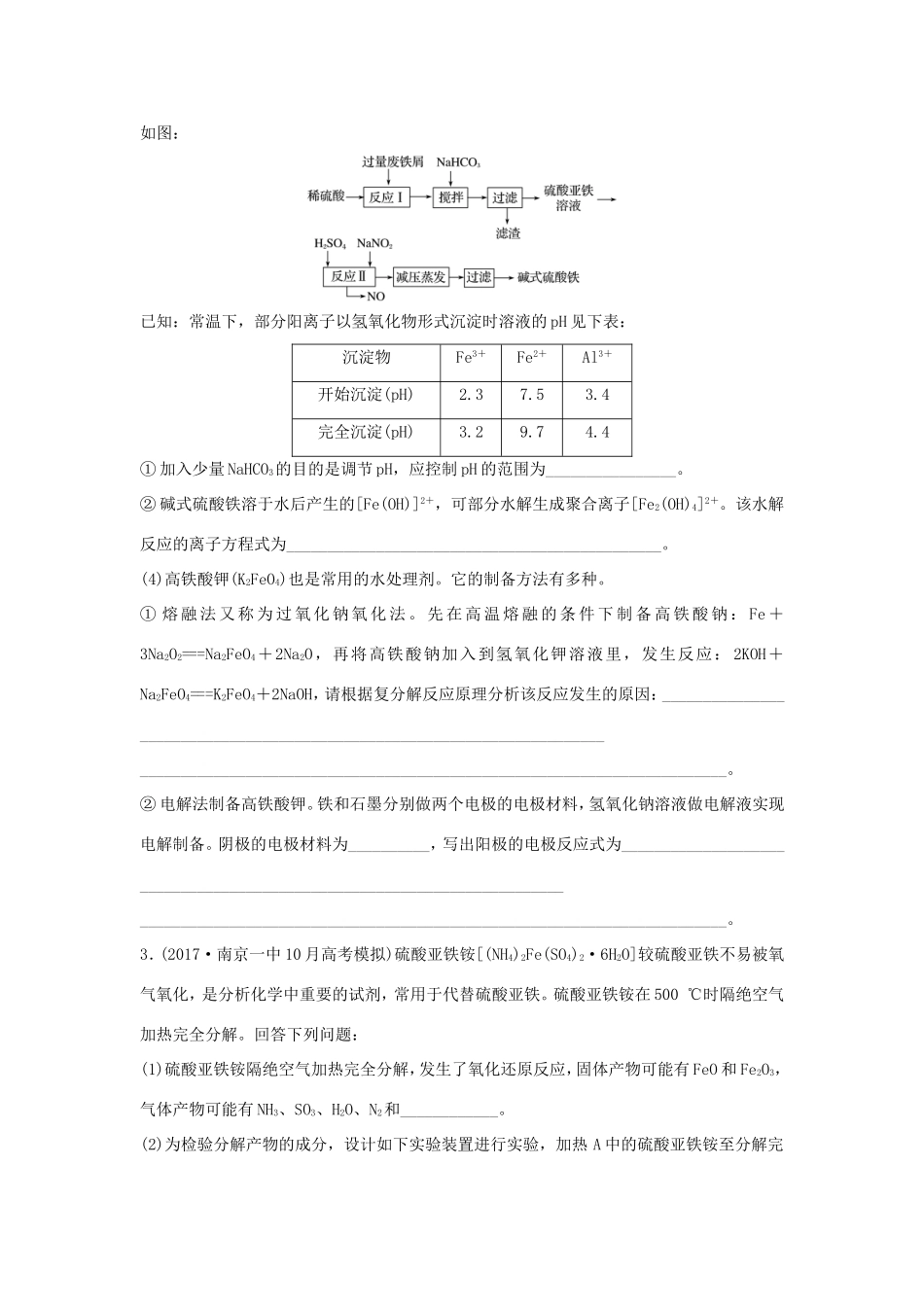
微考点20铁及其化合物的实验探究1.铁是目前人类使用量最大的金属,它能形成多种化合物。(1)取5.6g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是____________________________;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:________________________________________________________________________________________________________________________________________________。(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox和用于除去废气的转化关系为ZnFe2O4ZnFe2Ox。若上述转化反应中消耗的n(ZnFe2O4)∶n(H2)=2∶1,x的值为________。请写出ZnFe2Ox与NO2反应的化学方程式:____________________________________________(x用前一问求出的具体值)。(3)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,该反应还生成一种可燃性气体,则反应的化学方程式为________________________________________________。②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开)工作原理为FePO4+LiLiFePO4。则放电时正极上的电极反应式为________________________________________________________________________。(4)已知25℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5mol·L-1100mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入______mL2mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。2.铁及其化合物在生产和生活中有广泛的应用。(1)铁元素在元素周期表中的位置为________________。(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为__________;铁在高温条件下与水蒸气反应的化学方程式为________________________________________________________________________________________________________________________________________________。(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe3+Fe2+Al3+开始沉淀(pH)2.37.53.4完全沉淀(pH)3.29.74.4①加入少量NaHCO3的目的是调节pH,应控制pH的范围为________________。②碱式硫酸铁溶于水后产生的[Fe(OH)]2+,可部分水解生成聚合离子[Fe2(OH)4]2+。该水解反应的离子方程式为______________________________________________。(4)高铁酸钾(K2FeO4)也是常用的水处理剂。它的制备方法有多种。①熔融法又称为过氧化钠氧化法。先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2===Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4===K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因:________________________________________________________________________________________________________________________________________________。②电解法制备高铁酸钾。铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备。阴极的电极材料为__________,写出阳极的电极反应式为________________________________________________________________________________________________________________________________________________。3.(2017·南京一中10月高考模拟)硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和____________。(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚...