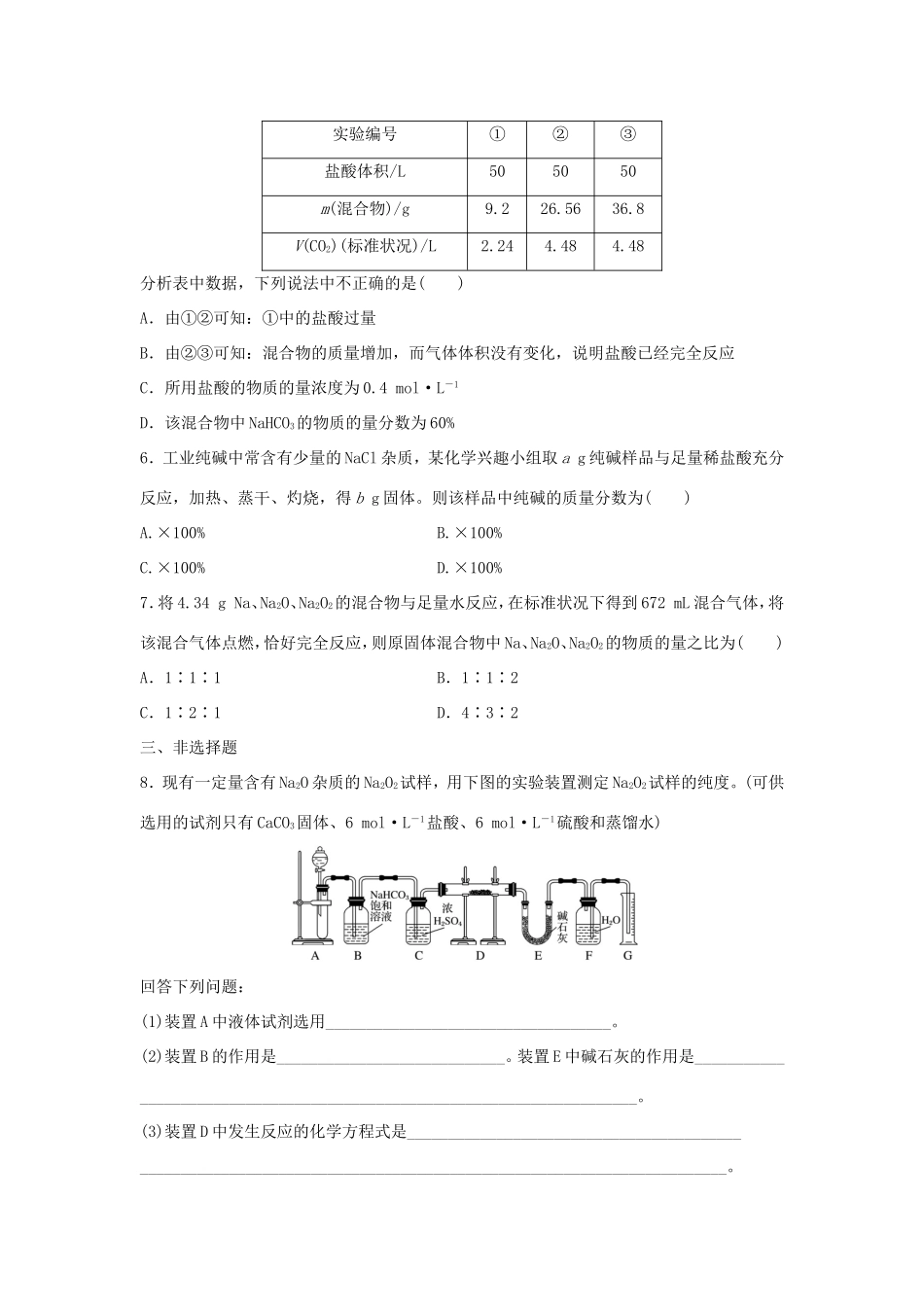
微考点16钠及其化合物的简单计算一、单项选择题1.在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol·L-1的HCl溶液中和,则该生成物的成分是()A.Na2OB.Na2O2C.Na2O和Na2O2D.Na2O2和NaO22.将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)()①Na2O2②Na2O③Na2CO3④NaClA.①>②>③>④B.①>②>④>③C.①=②>③=④D.①=②>③>④3.向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。下列判断正确的是()A.在0~a范围内,只发生中和反应B.ab段发生反应的离子方程式为CO+2H+===CO2↑+H2OC.a=0.3D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶24.将一定量的NaOH和NaHCO3的混合物X放在密闭容器中加热,充分反应后生成V1L气体Z(V1≠0)。反应后的固体残渣Y与过量的稀盐酸反应,又生成V2L气体Z(V1、V2均为标准状况下气体的体积)。下列判断错误的是()A.Y的成分为Na2CO3B.Z的成分为CO2C.V1>V2D.X中n(Na+)=mol二、不定项选择题5.某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:实验编号①②③盐酸体积/L505050m(混合物)/g9.226.5636.8V(CO2)(标准状况)/L2.244.484.48分析表中数据,下列说法中不正确的是()A.由①②可知:①中的盐酸过量B.由②③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经完全反应C.所用盐酸的物质的量浓度为0.4mol·L-1D.该混合物中NaHCO3的物质的量分数为60%6.工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取ag纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体。则该样品中纯碱的质量分数为()A.×100%B.×100%C.×100%D.×100%7.将4.34gNa、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到672mL混合气体,将该混合气体点燃,恰好完全反应,则原固体混合物中Na、Na2O、Na2O2的物质的量之比为()A.1∶1∶1B.1∶1∶2C.1∶2∶1D.4∶3∶2三、非选择题8.现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)回答下列问题:(1)装置A中液体试剂选用___________________________________。(2)装置B的作用是____________________________。装置E中碱石灰的作用是________________________________________________________________________。(3)装置D中发生反应的化学方程式是_________________________________________________________________________________________________________________。(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为________。答案精析1.C[由于n(NaOH)=n(HCl)=80mL×10-3L·mL-1×0.50mol·L-1=0.04mol,由Na原子守恒,若生成物为Na2O,则m(Na2O)=0.04mol××62g·mol-1=1.24g<1.5g;若生成物为Na2O2,则m(Na2O2)=0.04mol××78g·mol-1=1.56g>1.5g。则生成物是Na2O与Na2O2的混合物。]2.D3.C[在0~a范围内发生反应:OH-+H+===H2O和CO+H+===HCO,A错误;而a~b段发生反应:HCO+H+===H2O+CO2↑,B错误;在a~b段:n(CO2)=n(H+)=0.01mol,V(HCl)=0.1L,所以a=0.4-0.1=0.3,C正确;由碳元素守恒知n(Na2CO3)=n(CO2)=0.01mol,在0~a范围内,生成0.01molHCO消耗0.01mol盐酸,故NaOH消耗盐酸为0.03mol-0.01mol=0.02mol,原混合溶液中NaOH的物质的量为0.02mol,因此原混合溶液中NaOH与Na2CO3物质的量之比为2∶1,D错误。]4.C[X加热后有CO2生成,所以反应后固体残渣Y中一定无NaOH,只有Na2CO3,依据Na2CO3+2HCl===2NaCl+H2O+CO2↑可知,残渣Y(Na2CO3)的物质的量为mol,依据Na守恒可知X中n(Na+)=×2,A、B、D均正确;C选项V2>V1。]5.CD[由表中数据看出,在①中,盐酸过量,在③中,固体过量,故c(HCl)===4mol·L-1,C项错误;由数据①,9.2g固体全部参加反应,根据碳守恒可得:n(NaHCO3)+n(KHCO3...