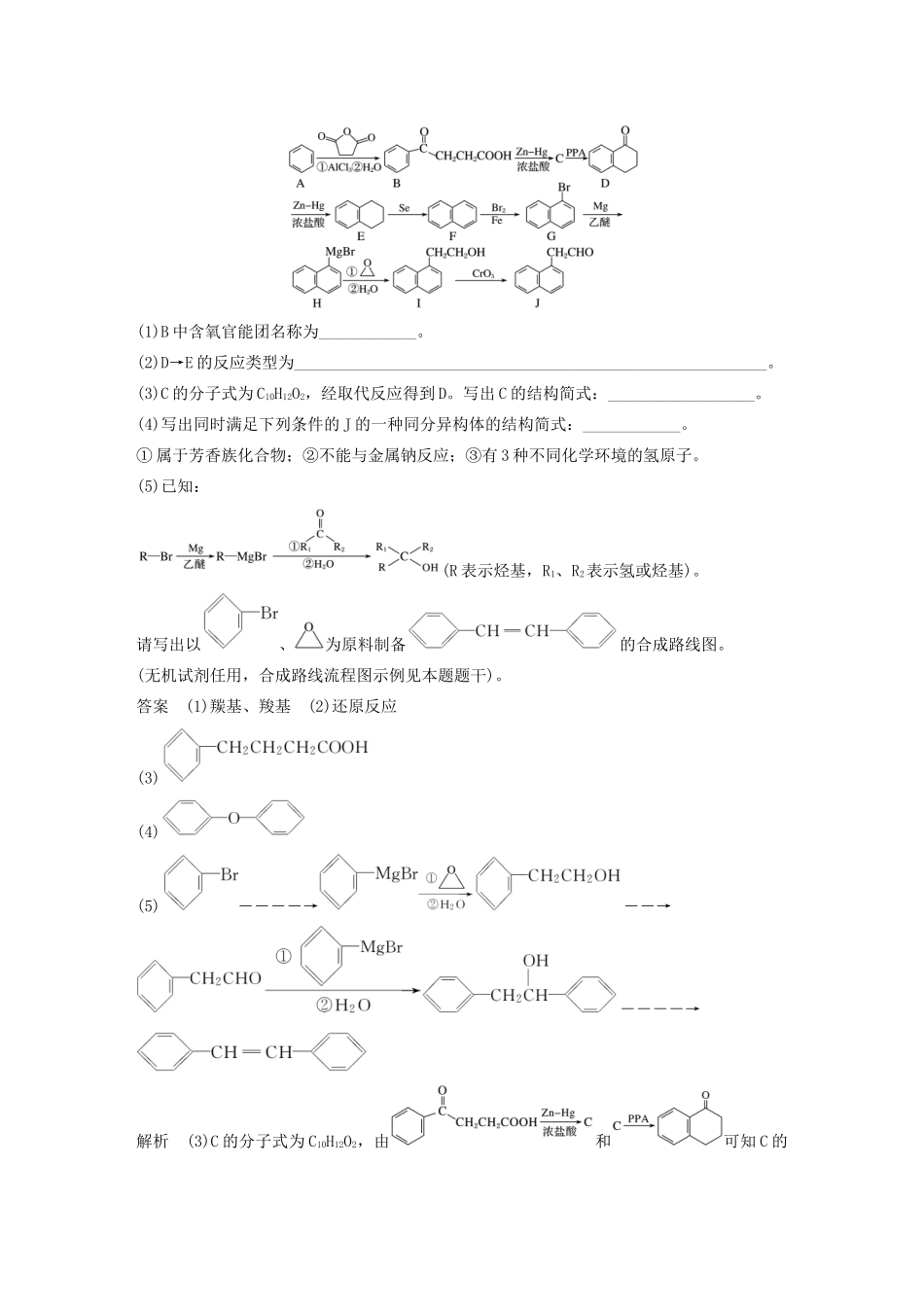
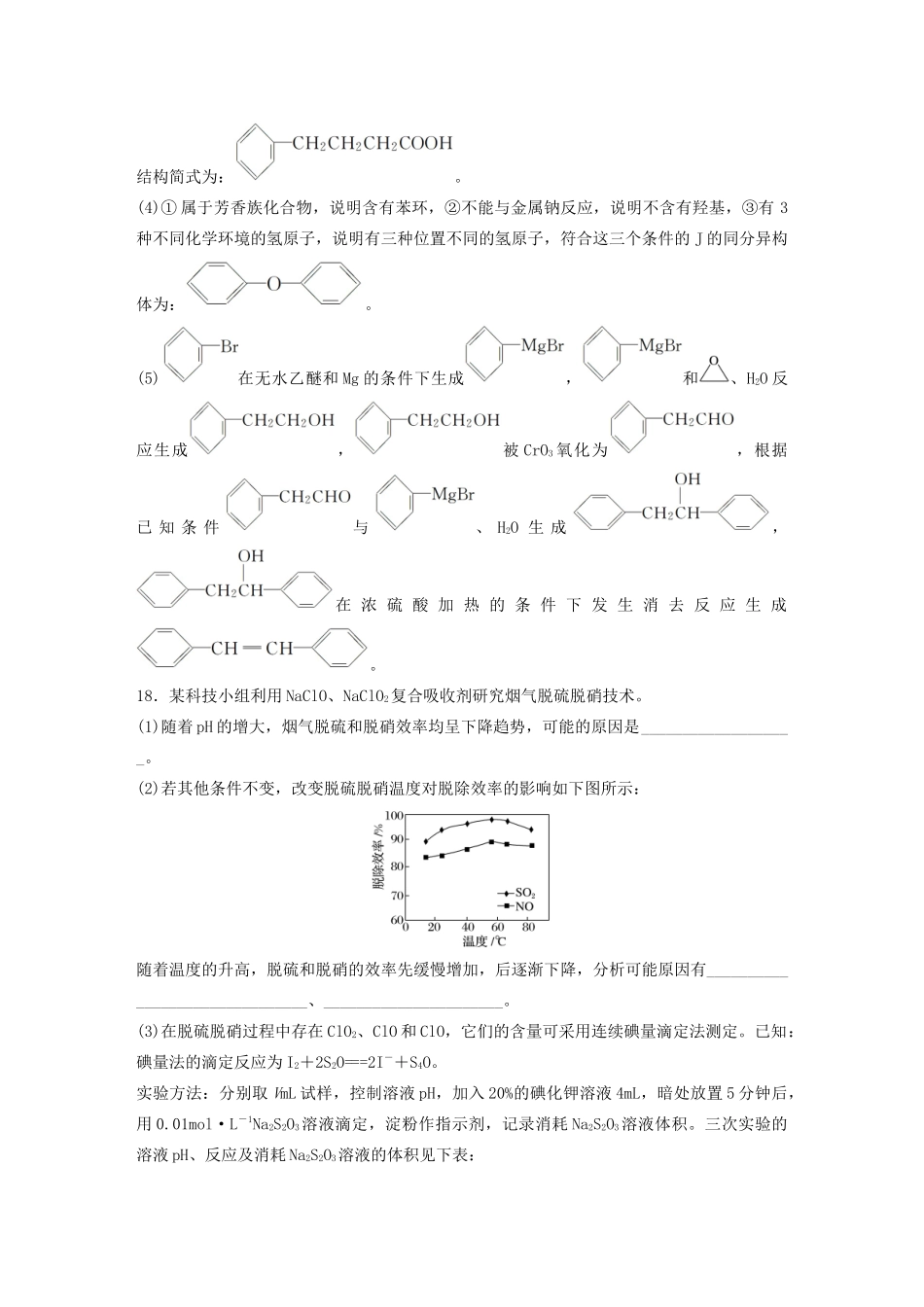
非选择题规范练二16.工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:(1)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为________和________(填离子符号)。(2)写出氧化过程中MnO2与SO2反应的化学方程式:________________________________________________________________________。(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是________。(4)向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度控制在30~35℃,温度不宜太高的原因是________________________________________________________________________。(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:________________________________________________________________________。(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________。答案(1)Mn2+Fe2+(2)MnO2+SO2===MnSO4(3)90℃(4)防止NH4HCO3受热分解,提高原料利用率(5)Mn2++2HCO===MnCO3↓+CO2↑+H2O(6)取1~2mL最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净17.化合物J是一种重要的有机中间体,可以由苯合成:(1)B中含氧官能团名称为____________。(2)D→E的反应类型为__________________________________________________________。(3)C的分子式为C10H12O2,经取代反应得到D。写出C的结构简式:__________________。(4)写出同时满足下列条件的J的一种同分异构体的结构简式:____________。①属于芳香族化合物;②不能与金属钠反应;③有3种不同化学环境的氢原子。(5)已知:(R表示烃基,R1、R2表示氢或烃基)。请写出以、为原料制备的合成路线图。(无机试剂任用,合成路线流程图示例见本题题干)。答案(1)羰基、羧基(2)还原反应(3)(4)(5)――――→――→――――→解析(3)C的分子式为C10H12O2,由和可知C的结构简式为:。(4)①属于芳香族化合物,说明含有苯环,②不能与金属钠反应,说明不含有羟基,③有3种不同化学环境的氢原子,说明有三种位置不同的氢原子,符合这三个条件的J的同分异构体为:。(5)在无水乙醚和Mg的条件下生成,和、H2O反应生成,被CrO3氧化为,根据已知条件与、H2O生成,在浓硫酸加热的条件下发生消去反应生成。18.某科技小组利用NaClO、NaClO2复合吸收剂研究烟气脱硫脱硝技术。(1)随着pH的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是___________________。(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有_______________________________、______________________。(3)在脱硫脱硝过程中存在ClO2、ClO和ClO,它们的含量可采用连续碘量滴定法测定。已知:碘量法的滴定反应为I2+2S2O===2I-+S4O。实验方法:分别取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol·L-1Na2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:实验pH反应Na2S2O3溶液体积/mL①pH=7.02ClO2+2I-===I2+2ClOV1②pH=4.0ClO+4I-+4H+===2I2+Cl-+2H2OV2③pH<0.1ClO+6I-+6H+===3I2+Cl-+3H2O2ClO2+10I-+8H+===5I2+2Cl-+4H2OClO+4I-+4H+===2I2+Cl-+2H2OV3注:实验②控制pH前先鼓入氮气以除去ClO2。计算试样中ClO的浓度为多少mg·L-1(写出计算过程,用含V1、V2、V3、V的代数式表示)。答案(1)吸收液的氧化性随着pH的增加而降低(2)温度升高反应速率增大(或温度升高能提高吸收液的氧化能力)温度过高会使气体的溶解度降低(3)三次滴定消耗的S2O的物质的量依次为10-5V1mol、10-5V2mol、10-5V3mol由实验①可知:2ClO2~I2~2S2O10-5V1mol10-5V1mol由实验②可知:ClO~2I2~4S2O2.5×10-6V2mol10-5V2mol由实验③可知:2ClO2~5I2~10S2O10-5V1mol5×10-5V1molClO~2I2~4...