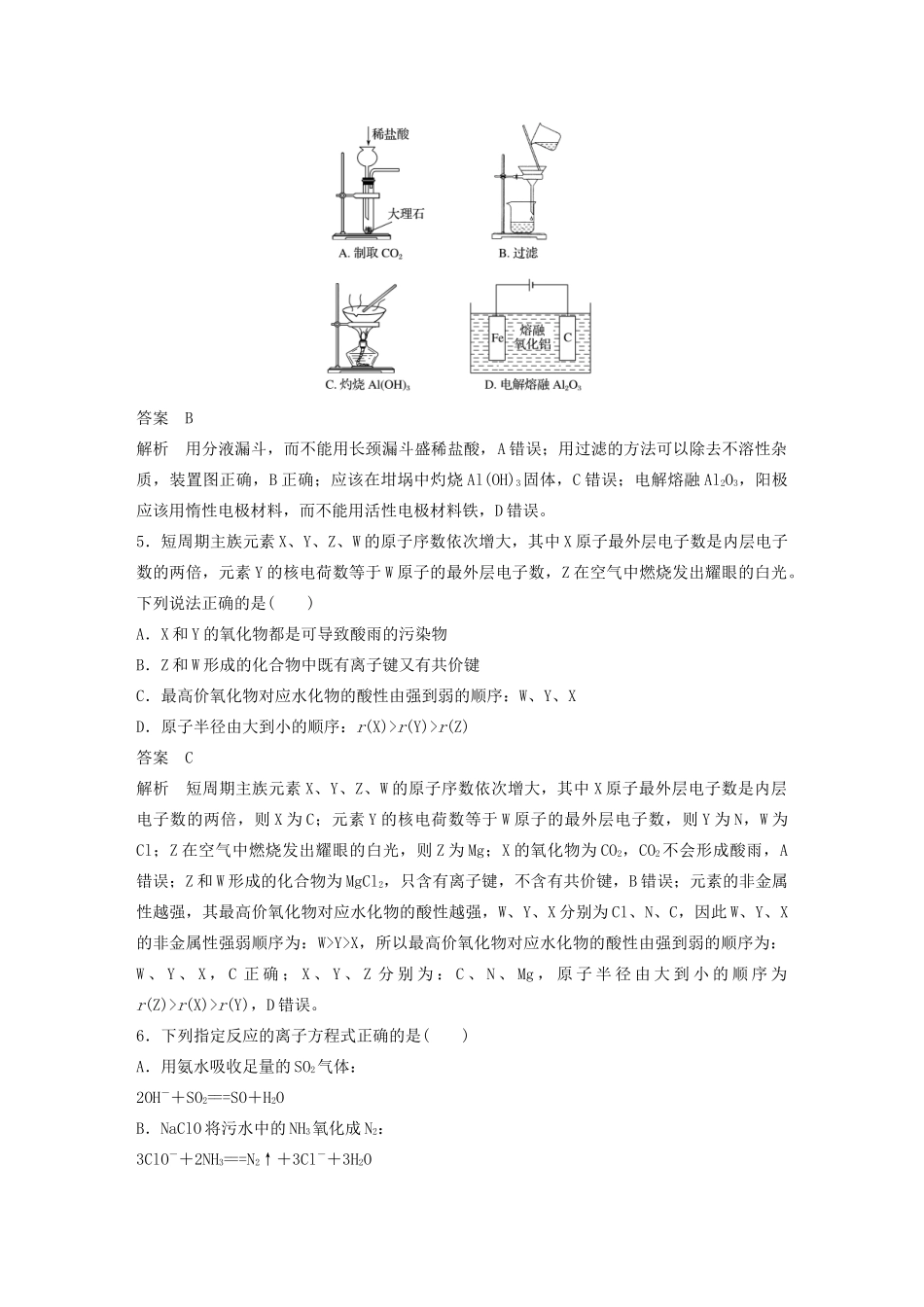
单项选择题专练三1.党的十九大进一步强调加强生态文明建设,倡导绿水青山就是金山银山。下列做法不符合该理念的是()A.燃煤发电B.植树造林C.普及新能源汽车D.节约用电答案A2.下列有关化学用语表示正确的是()A.质子数为117,中子数为176的Ts原子:TsB.Al3+的结构示意图:C.Na2O的电子式:D.磁性氧化铁的化学式:Fe2O3答案C解析质量数=质子数+中子数,因此质子数为117,中子数为176的Ts原子表示为:Ts,A错误;Al3+的最外层有8个电子,其正确的离子结构示意图为:,B错误;Na2O为离子化合物,电子式为:,C正确;磁性氧化铁的化学式为Fe3O4,D错误。3.(2019·南通、扬州、泰州、徐州、淮安、宿迁、连云港七市高三三模)下列有关物质性质与用途具有对应关系的是()A.次氯酸具有弱酸性,可用作有色物质的漂白剂B.硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂C.浓硫酸具有强氧化性,可用作酯化反应的催化剂D.铅具有还原性和导电性,可用作铅蓄电池的负极材料答案D解析A项,HClO具有强氧化性,可以用于漂白物质,错误;B项,Cu2+具有氧化性,可以用于消毒,错误;C项,浓硫酸作酯化反应的催化剂,并不是因为其具有强氧化性,错误;D项,Pb失去电子生成Pb2+,表现为还原性,作电极材料必须具有导电性,正确。4.实验室用铝土矿制铝,需经过NaOH溶液溶解、过滤、通入CO2气体、过滤、灼烧、电解等步骤,下列图示能达到实验目的的是()答案B解析用分液漏斗,而不能用长颈漏斗盛稀盐酸,A错误;用过滤的方法可以除去不溶性杂质,装置图正确,B正确;应该在坩埚中灼烧Al(OH)3固体,C错误;电解熔融Al2O3,阳极应该用惰性电极材料,而不能用活性电极材料铁,D错误。5.短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,元素Y的核电荷数等于W原子的最外层电子数,Z在空气中燃烧发出耀眼的白光。下列说法正确的是()A.X和Y的氧化物都是可导致酸雨的污染物B.Z和W形成的化合物中既有离子键又有共价键C.最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、XD.原子半径由大到小的顺序:r(X)>r(Y)>r(Z)答案C解析短周期主族元素X、Y、Z、W的原子序数依次增大,其中X原子最外层电子数是内层电子数的两倍,则X为C;元素Y的核电荷数等于W原子的最外层电子数,则Y为N,W为Cl;Z在空气中燃烧发出耀眼的白光,则Z为Mg;X的氧化物为CO2,CO2不会形成酸雨,A错误;Z和W形成的化合物为MgCl2,只含有离子键,不含有共价键,B错误;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,W、Y、X分别为Cl、N、C,因此W、Y、X的非金属性强弱顺序为:W>Y>X,所以最高价氧化物对应水化物的酸性由强到弱的顺序为:W、Y、X,C正确;X、Y、Z分别为:C、N、Mg,原子半径由大到小的顺序为r(Z)>r(X)>r(Y),D错误。6.下列指定反应的离子方程式正确的是()A.用氨水吸收足量的SO2气体:2OH-+SO2===SO+H2OB.NaClO将污水中的NH3氧化成N2:3ClO-+2NH3===N2↑+3Cl-+3H2OC.酸性条件下,用H2O2将Fe2+转化为Fe3+:H2O2+Fe2++2H+===Fe3++2H2OD.NH4Al(SO4)2溶液与过量NaOH溶液反应:Al3++4OH-===AlO+2H2O答案B解析用氨水吸收足量的SO2气体,反应生成亚硫酸氢铵,正确的离子方程式为:NH3·H2O+SO2===NH+HSO,A错误;NaClO具有强氧化性,NH3具有还原性,NaClO能将NH3氧化成N2,离子方程式为:3ClO-+2NH3===N2↑+3Cl-+3H2O,B正确;酸性条件下,用H2O2将Fe2+转化为Fe3+,正确的离子方程式为:H2O2+2Fe2++2H+===2Fe3++2H2O,C错误;NH4Al(SO4)2溶液与过量NaOH溶液反应的正确的离子方程式为:NH+Al3++5OH-===AlO+2H2O+NH3·H2O,D错误。7.在给定条件下,下列选项所示的物质转化均能实现的是()A.S――→SO2――→CaSO4B.Si――→SiO2――→SiCl4C.Fe――→Fe2O3――→Fe(OH)3D.Na――→NaOH(aq)――→NaHCO3(aq)答案D解析二氧化硫与氧化钙反应生成CaSO3,A错误;二氧化硅是酸性氧化物与盐酸不反应,所以二氧化硅无法与盐酸反应转化为四氯化硅,B错误;Fe与H2O在高温下反应生成Fe3O4,Fe2O3与H2O不反应,不能生成Fe(OH)3,C...