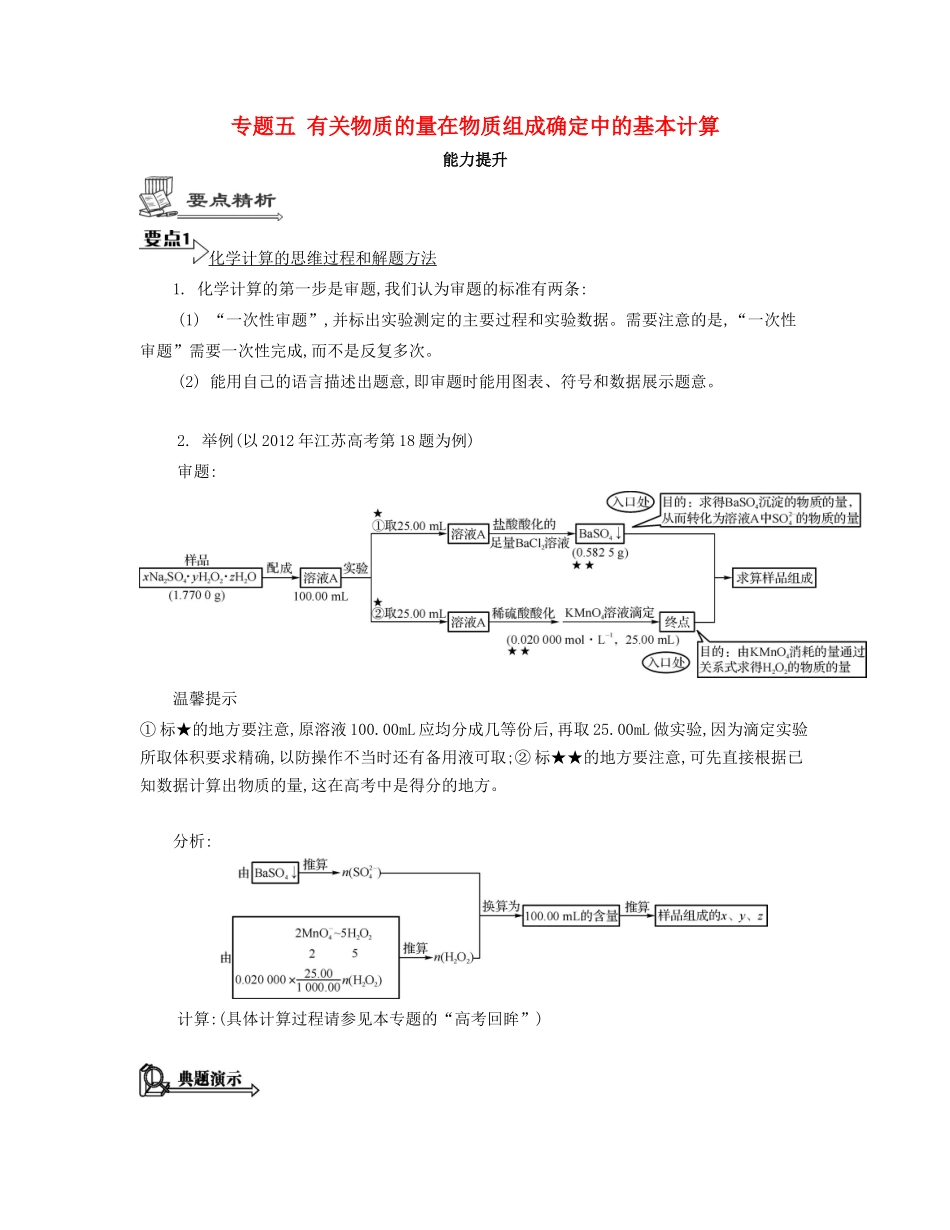
专题五有关物质的量在物质组成确定中的基本计算能力提升化学计算的思维过程和解题方法1.化学计算的第一步是审题,我们认为审题的标准有两条:(1)“一次性审题”,并标出实验测定的主要过程和实验数据。需要注意的是,“一次性审题”需要一次性完成,而不是反复多次。(2)能用自己的语言描述出题意,即审题时能用图表、符号和数据展示题意。2.举例(以2012年江苏高考第18题为例)审题:温馨提示①标★的地方要注意,原溶液100.00mL应均分成几等份后,再取25.00mL做实验,因为滴定实验所取体积要求精确,以防操作不当时还有备用液可取;②标★★的地方要注意,可先直接根据已知数据计算出物质的量,这在高考中是得分的地方。分析:计算:(具体计算过程请参见本专题的“高考回眸”)混合物的计算典题演示1(2014·南通三模)高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。(1)工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。请结合相关信息,补充完整提纯硝酸锶的下列实验步骤:①取含杂质的硝酸锶样品,,搅拌。②。③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH=78,过滤。④将滤液用硝酸调节pH=23,,过滤,洗涤。⑤将得到的Sr(NO3)2·2H2O晶体在100℃条件下干燥,得到高纯硝酸锶。(2)Sr(NO3)2受热易分解成Sr(NO2)2和O2;在500℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20gSrO固体和5.08g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)。[答案](1)①向其中加入浓硝酸②过滤,并用浓硝酸洗涤滤渣④蒸发浓缩,冷却结晶(2)m(样品)=5.20g+5.08g=10.28gn(SrO)==0.05mol解得:n[Sr(NO3)2]=0.04mol,n[Sr(NO2)2]=0.01molw[Sr(NO3)2]=×100%=82.49%[解析](1)①根据信息提示,硝酸钙溶于浓硝酸,先加入浓硝酸溶解硝酸钙;②过滤后,再用浓硝酸洗涤滤渣中残留的硝酸钙,最终滤渣主要成分为硝酸锶、硝酸钡;④步骤③除去了Ba2+,滤液中主要成分为硝酸锶,防止硝酸锶的水解,所以需要冷却结晶。变式训练1(2014·南京考前指导)高铁酸钠(Na2FeO4)是一种高效多功能水处理剂。工业上常采用NaClO氧化法生产,反应原理为:在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4,过滤得到粗产品,再用NaOH溶液溶解,重结晶,用有机溶剂脱碱,低温烘干得到固体样品。化学方程式为3NaClO+2Fe(NO3)3+10NaOH2Na2FeO4↓+3NaCl+6NaNO3+5H2O。-15.20g104gmol-1-132223222[Sr(NO)]212l[Sr(NO)]180l10.28[Sr(NO)][Sr(NO)]0.05ngmongmognnmol-10.04mol212gmol10.28g(1)上述制备过程中,用NaOH溶液溶解粗产品而不用水的原因是。(2)高铁酸钠电池是一种新型可充电电池,电解质为NaOH溶液,放电时负极材料为Zn,正极产生红褐色沉淀,写出该电池的总反应式:。(3)生产Na2FeO4的原料之一Fe(NO3)3用黑色粉末Fe(含有Fe3O4)与稀硝酸反应制备。准确称取该黑色粉末13.12g,加入200mL4mol·L-1HNO3搅拌,固体完全溶解,共收集到标准状况下2688mL的气体,经分析其中只含有NO,并测得此时溶液中c(H+)=0.4mol·L-1(设反应前后溶液体积不变)。通过以上数据,计算该黑色粉末中Fe的质量分数(写出计算过程,结果保留两位小数)。[答案](1)Na2FeO4在水溶液中易水解,水解后溶液呈碱性,NaOH溶液呈碱性会抑制其水解,有利于减少产品损失(2)3Zn+2Na2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4NaOH(3)n(NO)==0.12mol溶液中还有H+,说明硝酸未反应完,所以溶液中只含Fe3+溶液中有n(N)=4mol·L-1×200×10-3L-0.12mol=0.68mol根据电荷守恒n(N)×1=n(H+)×1+n(Fe3+)×3,n(Fe3+)=0.2mol,样品中所有铁元素的物质的量为0.2mol设样品中Fe的物质的量为x,Fe3O4的物质的量为y。解得:x=0.11moly=0.03mol单质铁的质量分数为×100%=47%[解析](1)水解显碱性的盐,若向其中加入碱,会抑制盐的水解。(2)放电时Zn作负极,正极为Na2FeO4,反应产物为Zn(OH)2和红褐色的Fe(OH)3,依据得失电子守恒和元素守恒配平反应方程式。(3)依据电荷守恒确定出Fe3+的物质的量,根据质量关系和铁守恒列式得出Fe和Fe3O4的物质的量,由此计算出Fe的质量分数。化学式的确定...