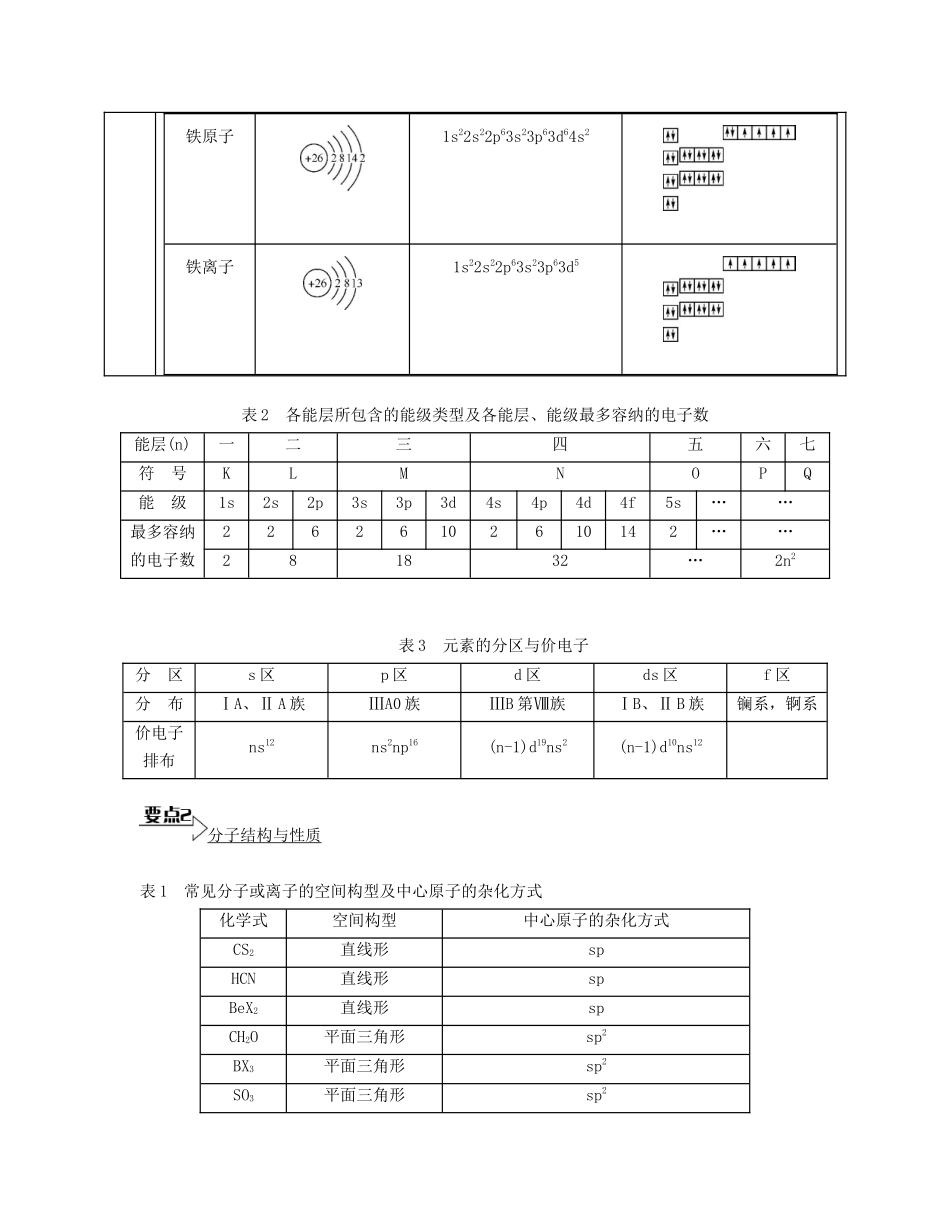
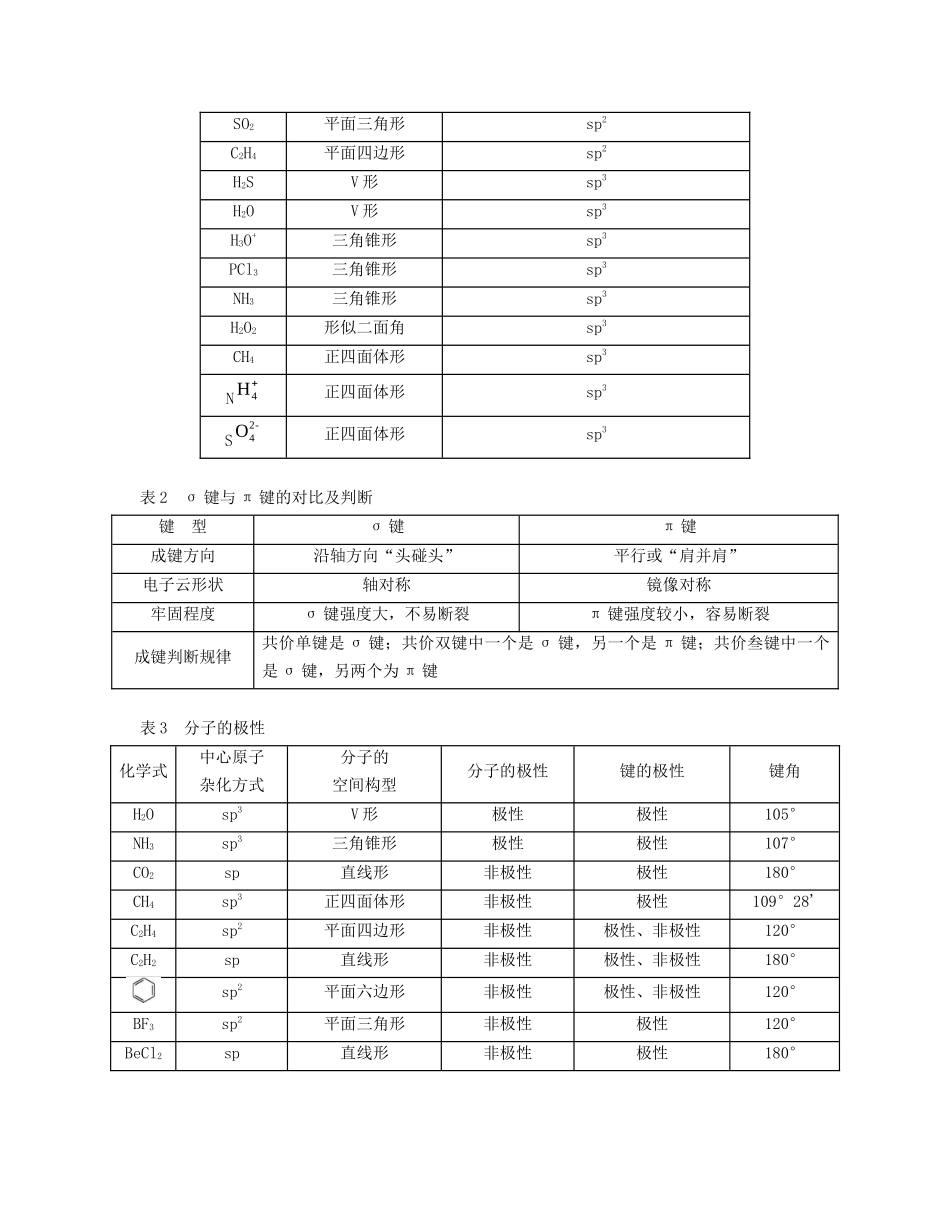
专题九原子、分子、晶体结构与性质【能力提升】原子结构与性质表1电子排布式与轨道表示式的比较电子排布式①特殊原子或离子的电子排布式②有时为了简洁采用原子实的形式书写,如K原子的核外电子排布为1s22s22p63s23p64s1,可简写为[Ar]4s1。24Cr:1s22s22p63s23p63d54s129Cu:1s22s22p63s23p63d104s126Fe:1s22s22p63s23p63d64s2常见的错误如下:Cr3+:1s22s22p63s23p63d14s2Cu+:1s22s22p63s23p63d84s2Fe2+:1s22s22p63s23p63d54s1轨道表示式第2周期元素基态原子的电子排布如下图所示(图中每个方框代表一个原子轨道,每个箭头代表一个电子,“↑”、“↓”表示电子的自旋方向相反):原子的性质原子的性质主要包括:电离能、电负性、原子半径、金属性、非金属性、失电子性、得电子性、还原性、氧化性等。注意:有些元素(如过渡元素)的原子参与化学反应时除了最外层的电子参与外,次外层的电子也参与了,如Fe。以下是表示铁原子和铁离子的3种不同的化学用语:结构示意图电子排布式电子排布图(轨道表示式)铁原子1s22s22p63s23p63d64s2铁离子1s22s22p63s23p63d5表2各能层所包含的能级类型及各能层、能级最多容纳的电子数能层(n)一二三四五六七符号KLMNOPQ能级1s2s2p3s3p3d4s4p4d4f5s……最多容纳的电子数22626102610142……281832…2n2表3元素的分区与价电子分区s区p区d区ds区f区分布ⅠA、ⅡA族ⅢA0族ⅢB第Ⅷ族ⅠB、ⅡB族镧系,锕系价电子排布ns12ns2np16(n-1)d19ns2(n-1)d10ns12分子结构与性质表1常见分子或离子的空间构型及中心原子的杂化方式化学式空间构型中心原子的杂化方式CS2直线形spHCN直线形spBeX2直线形spCH2O平面三角形sp2BX3平面三角形sp2SO3平面三角形sp2SO2平面三角形sp2C2H4平面四边形sp2H2SV形sp3H2OV形sp3H3O+三角锥形sp3PCl3三角锥形sp3NH3三角锥形sp3H2O2形似二面角sp3CH4正四面体形sp3N正四面体形sp3S正四面体形sp3表2σ键与π键的对比及判断键型σ键π键成键方向沿轴方向“头碰头”平行或“肩并肩”电子云形状轴对称镜像对称牢固程度σ键强度大,不易断裂π键强度较小,容易断裂成键判断规律共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价叁键中一个是σ键,另两个为π键表3分子的极性化学式中心原子杂化方式分子的空间构型分子的极性键的极性键角H2Osp3V形极性极性105°NH3sp3三角锥形极性极性107°CO2sp直线形非极性极性180°CH4sp3正四面体形非极性极性109°28'C2H4sp2平面四边形非极性极性、非极性120°C2H2sp直线形非极性极性、非极性180°sp2平面六边形非极性极性、非极性120°BF3sp2平面三角形非极性极性120°BeCl2sp直线形非极性极性180°4H2-4O表4等电子体等电子体的条件构成微粒的原子总数和价电子总数相同空间结构等电子体的性质相似,结构上也存在某些相似性,如N、CH4互为等电子体,其结构皆为正四面体形。常利用等电子原理判断一些简单分子或离子的立体构型及轨道杂化方式。如CO2、N2O、OCN-、SCN-、为等电子体,结构相似,为直线形,中心原子轨道杂化方式为sp杂化10电子分子和原子:Ne、HF、H2O、NH3、CH4等;离子:F-、OH-、H3O+、N、N、N3-、O2-、Na+、Mg2+、Al3+等,其中HF与OH-;H2O与NH2-;NH3与H3O+;CH4与NH4+互为等电子体。14电子分子和原子:Si、N2、CO、C2H2等,离子:(CaC2)等18电子分子和原子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4(肼)、C2H6(乙烷)、CH3OH等,离子:Cl-、HS-、S2-、P、、K+、Ca2+、N2、N2等,其中HCl与HS-;C2H6与N2互为等电子体。表5化学键与分子间作用力的比较化学键分子间作用力共价键离子键金属键范德华力氢键存在分子或物质的内部分子间分子间或部分分子内部强弱判断键长越短,键能越大,共价键越强①电荷越大,离子键越强②成键的阴、阳离子半径越小,离子键越强①与金属阳离子所带电荷成正比②与阳离子半径成反比相对分子质量越大,范德华力越强在X-H…Y中,X、Y元素的电负性越大,形成的氢键越强对物质性质的影响化学性质物理性质和化学性质物理性质和化学性质熔、沸点(物理性熔、沸点,溶解度(物理性质)4H-3N-2H4H2-2C4H2-2O5H26H26H质)表6配合物配合物的组成[中心离子(配...