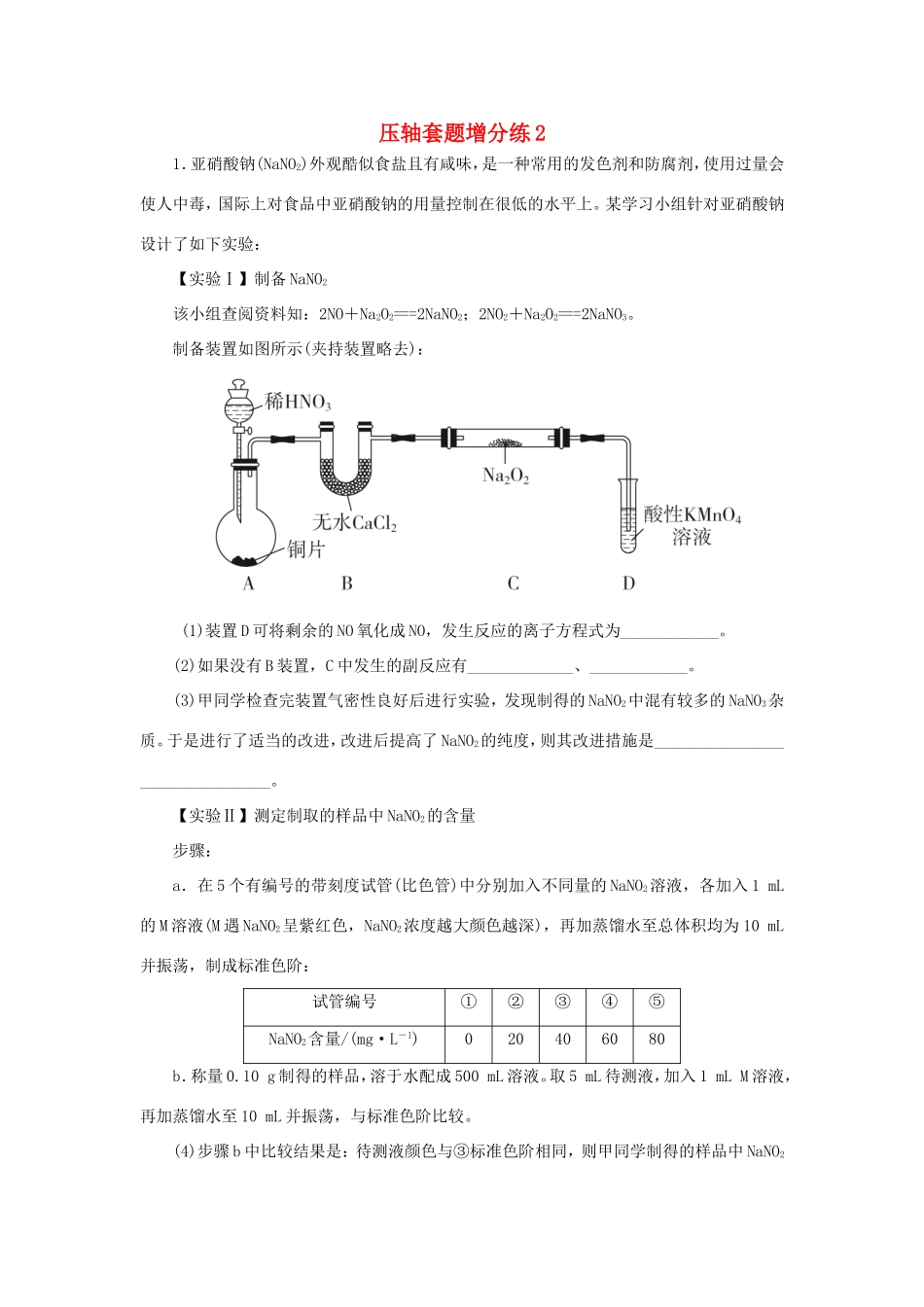
压轴套题增分练21.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:【实验Ⅰ】制备NaNO2该小组查阅资料知:2NO+Na2O2===2NaNO2;2NO2+Na2O2===2NaNO3。制备装置如图所示(夹持装置略去):(1)装置D可将剩余的NO氧化成NO,发生反应的离子方程式为____________。(2)如果没有B装置,C中发生的副反应有_____________、____________。(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。【实验Ⅱ】测定制取的样品中NaNO2的含量步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:试管编号①②③④⑤NaNO2含量/(mg·L-1)020406080b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM溶液,再加蒸馏水至10mL并振荡,与标准色阶比较。(4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。实验方案实验现象实验结论取5mL待测液,加入______________,振荡,再加入1mLM溶液,____________________________________,再振荡,与③标准色阶对比________________________________维生素C可以有效降低NaNO2的含量答案(1)5NO+3MnO+4H+===5NO+3Mn2++2H2O(2)2Na2O2+2H2O===4NaOH+O2↑2NO+O2===2NO22NO2+Na2O2===2NaNO3(3)在A、B之间增加装有水的洗气瓶(4)40%(5)维生素C加入蒸馏水至总体积为10mL紫红色比③标准色阶浅解析(1)酸性KMnO4溶液具有强氧化性,能将NO氧化为NO,反应的离子方程式为5NO+3MnO+4H+===5NO+3Mn2++2H2O。(2)铜和稀硝酸反应制得的NO中含有杂质水蒸气。(3)制得的NaNO2中混有较多的NaNO3杂质,说明制得的NO中混有NO2,故应在装置A、B之间增加装有水的洗气瓶,以除去杂质NO2。(4)待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量是40mg·L-1×0.01L×=40mg=0.04g,故样品中NaNO2的质量分数=×100%=40%。(5)取5mL待测液,然后加入维生素C,再加入1mLM溶液,最后加入蒸馏水至总体积为10mL,若紫红色比③标准色阶浅,说明NaNO2的含量低,则可以证明维生素C可以有效降低NaNO2的含量。2.碲(Te)位于元素周期表第ⅥA族,由该元素组成的物质可用作石油裂化的催化剂,电镀液的光亮剂,玻璃的着色材料,合金材料的添加剂等。碲化铜渣是电解精炼铜时产生的一种矿渣,其主要含Cu2Te、Au、Ag等,利用下列工艺流程可回收碲:已知:TeO2的熔点为733℃,微溶于水,可溶于强酸和强碱。回答下列问题:(1)Te与S的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示)。(2)“酸浸1”需加热,加热的目的是______________________,“酸浸1”发生反应的氧化产物是______________(写化学式)。(3)“水浸”后“滤液1”的颜色是________。(4)“滤渣1”进行“碱浸”的离子方程式是_____________________。(5)“滤液2”加双氧水的目的是__________________________________,“操作1”的名称是____________________。(6)“还原”制备碲粉的离子方程式为_______________________。(7)从可持续发展意识和绿色化学观念来看,“滤渣2”进行酸浸的意义是________________________________。答案(1)H2SO4>H2TeO4(2)加快浸出速率CuSO4、TeO2(3)蓝色(或浅蓝色)(4)TeO2+2OH-===TeO+H2O(5)将Na2TeO3氧化为Na2TeO4加热浓缩(或浓缩)(6)TeO+3SO+2H+===3SO+Te↓+H2O(7)“滤渣2”经过酸浸可得到含CuSO4的滤液,并可达到回收Au、Ag的目的,符合可持续发展意识和绿色化学观念解析(1)S、Te同主族,同主族元素从上到下,非金属性逐渐减弱,故H2SO4的酸性比H2TeO4强。(2)酸浸时加热的目的是提高浸出速率,结合流程图知,...