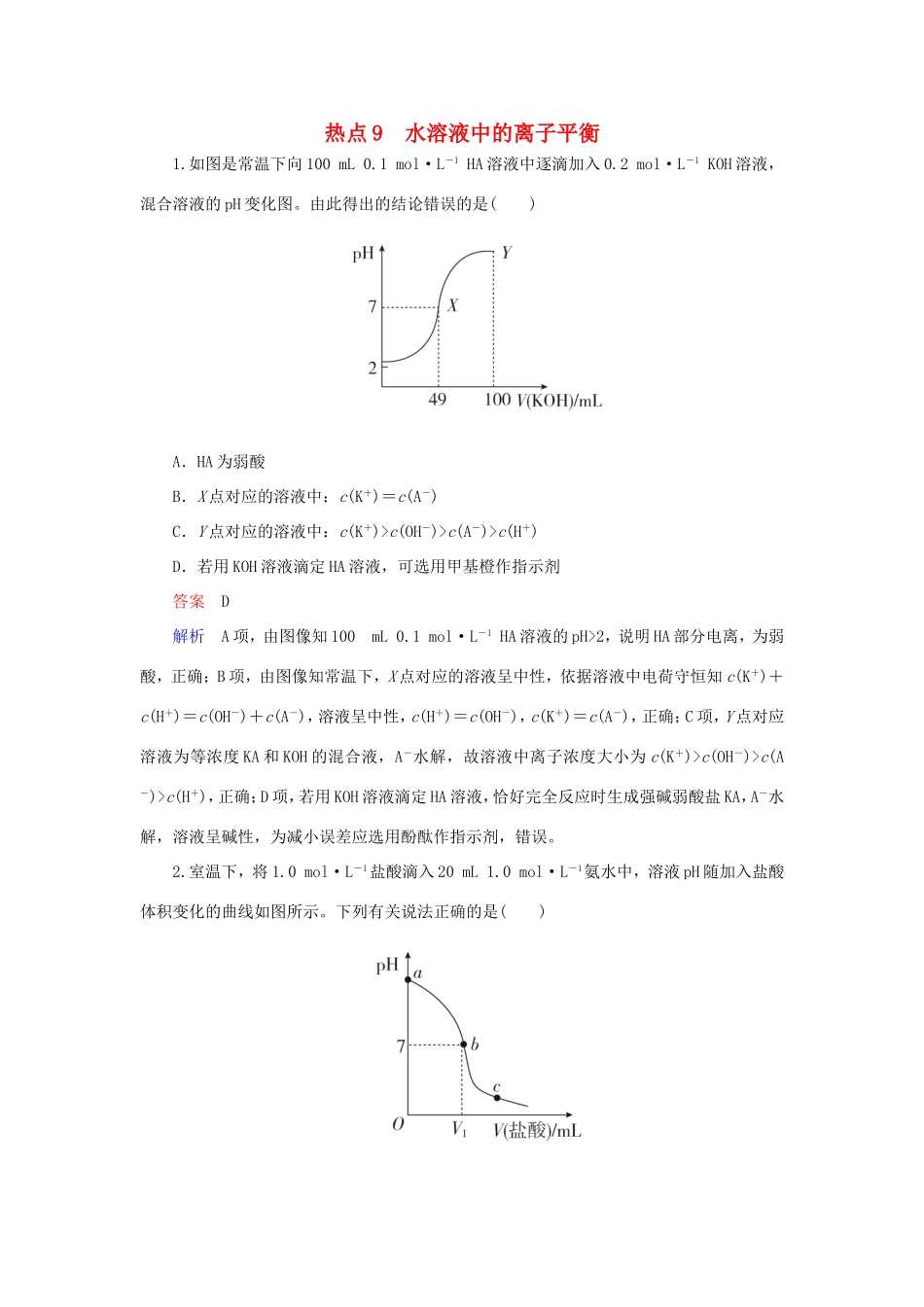
热点9水溶液中的离子平衡1.如图是常温下向100mL0.1mol·L-1HA溶液中逐滴加入0.2mol·L-1KOH溶液,混合溶液的pH变化图。由此得出的结论错误的是()A.HA为弱酸B.X点对应的溶液中:c(K+)=c(A-)C.Y点对应的溶液中:c(K+)>c(OH-)>c(A-)>c(H+)D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂答案D解析A项,由图像知100mL0.1mol·L-1HA溶液的pH>2,说明HA部分电离,为弱酸,正确;B项,由图像知常温下,X点对应的溶液呈中性,依据溶液中电荷守恒知c(K+)+c(H+)=c(OH-)+c(A-),溶液呈中性,c(H+)=c(OH-),c(K+)=c(A-),正确;C项,Y点对应溶液为等浓度KA和KOH的混合液,A-水解,故溶液中离子浓度大小为c(K+)>c(OH-)>c(A-)>c(H+),正确;D项,若用KOH溶液滴定HA溶液,恰好完全反应时生成强碱弱酸盐KA,A-水解,溶液呈碱性,为减小误差应选用酚酞作指示剂,错误。2.室温下,将1.0mol·L-1盐酸滴入20mL1.0mol·L-1氨水中,溶液pH随加入盐酸体积变化的曲线如图所示。下列有关说法正确的是()A.a点,pH=14B.V1>20mL,此时水的电离程度最大C.c(NH)+c(NH3·H2O)=c(Cl-)时,V(盐酸)=20mLD.c点可能存在c(NH)>c(Cl-)>c(H+)答案C解析A项,一水合氨是弱电解质,1.00mol·L-1氨水中存在电离平衡,所以溶液中c(OH-)<1.00mol·L-1,则溶液的pH小于14,错误;B项,V1对应的pH为7,说明V1<20mL,溶液中的溶质为NH4Cl和NH3·H2O,此时水的电离程度不是最大,错误;C项,c(NH)+c(NH3·H2O)=c(Cl-)时加入的盐酸和氨水等量,正确;D项,c点溶液显酸性,则c(H+)>c(OH-),若存在c(NH)>c(Cl-)>c(H+)>c(OH-),则c(NH)+c(H+)>c(Cl-)+c(OH-),不符合电荷守恒,错误。3.室温下,向0.01mol·L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线如图所示。下列分析正确的是()A.a点,pH=2B.b点,c(CH3COO-)>c(NH)C.c点,pH可能大于7D.ac段,溶液pH增大是CH3COO-逆向移动的结果答案B解析a点为0.01mol·L-1的醋酸溶液,由于醋酸为弱酸,不能完全电离,所以0.01mol·L-1的醋酸溶液pH>2,A错误;醋酸铵为中性溶液,所以向醋酸溶液中无限加入醋酸铵溶液,溶液的pH无限接近7,则b点溶液呈酸性,c(H+)>c(OH-),根据电荷守恒可知:c(H+)+c(NH)=c(OH-)+c(CH3COO-),故c(NH)