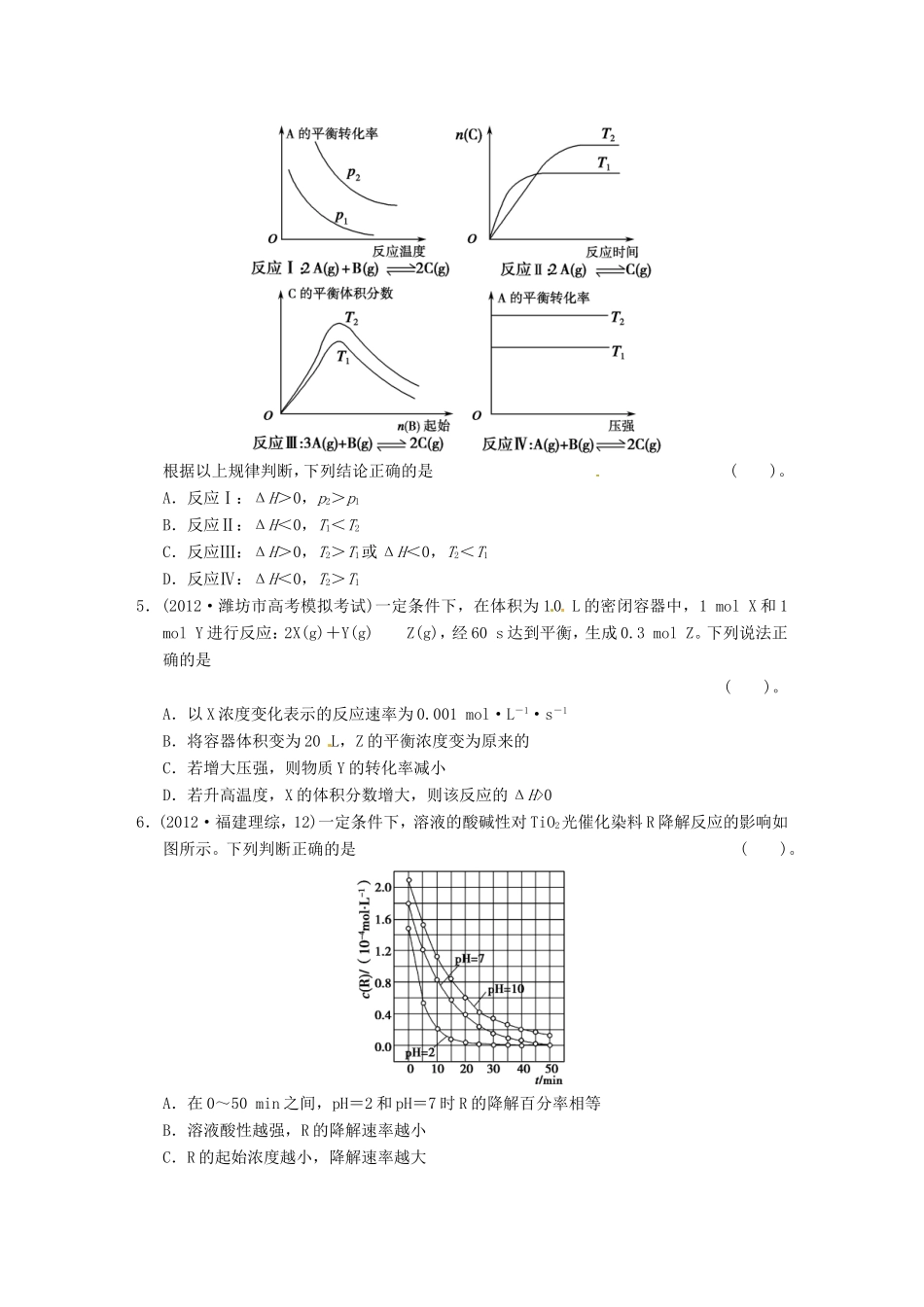
第六讲化学反应速率与化学平衡中的常考问题(时间:45分钟分值:100分)一、选择题(本题包括7个小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。)1.(教材题改编)在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g)平衡时测得A的浓度为0.50mol·L-1,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30mol·L-1。下列判断正确的是()。A.x+y<zB.平衡向正反应方向移动C.B的转化率增大D.C的体积分数下降2.(2011·天津理综,6)向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是()。A.反应在c点达到平衡状态B.反应物浓度:a点小于b点C.反应物的总能量低于生成物的总能量D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段3.(2012·安徽六校联考)某温度下,反应2A(g)B(g)(正反应为吸热反应)在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的是()。A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<bB.若a=b,则B容器中一定使用了催化剂C.若其他条件不变,升高温度,则有a<bD.若保持温度、压强不变,充入惰性气体,则有a>b4.(2012·长春调研)某化学科研小组研究在其他条件不变变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。根据以上规律判断,下列结论正确的是()。A.反应Ⅰ:ΔH>0,p2>p1B.反应Ⅱ:ΔH<0,T1<T2C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1D.反应Ⅳ:ΔH<0,T2>T15.(2012·潍坊市高考模拟考试)一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()。A.以X浓度变化表示的反应速率为0.001mol·L-1·s-1B.将容器体积变为20L,Z的平衡浓度变为原来的C.若增大压强,则物质Y的转化率减小D.若升高温度,X的体积分数增大,则该反应的ΔH>06.(2012·福建理综,12)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是()。A.在0~50min之间,pH=2和pH=7时R的降解百分率相等B.溶液酸性越强,R的降解速率越小C.R的起始浓度越小,降解速率越大D.在20~25min之间,pH=10时R的平均降解速率为0.04mol·L-1·min-17.(2012·四川理综,12)在体积恒定的密闭容器中,一定量的SO2与1.100molO2,在催化剂作用下加热到600℃发生反应:2SO2+O22SO3ΔH<0。当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是()。A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡B.降低温度,正反应速率减小程度比逆反应速率减小程度大C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980gD.达到平衡时,SO2的转化率为90%二、非选择题(本题包括4小题,共58分。)8.(14分)(2012·岳阳一中月考)25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图所示,已知达平衡后,降低温度,A的转化率将增大。(1)根据上图数据,写出该反应的化学方程式:______________________;此反应的平衡常数表达式K=________,从反应开始到达第一次平衡时的平均速率v(A)为________。(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________________________________________________________________。(3)下图表示此反应的反应速率v和时间t的关系图:各阶段的平衡常数如下表所示:t2-t3t4-t5t5-t6t7-t8K1K2K3K4K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。9.(14分)(2012·北京东城期末)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)SiO2(s)+4HF(g)ΔH=+148.9kJ·mol-1。(1)下列各项中能说明该反应已达化...