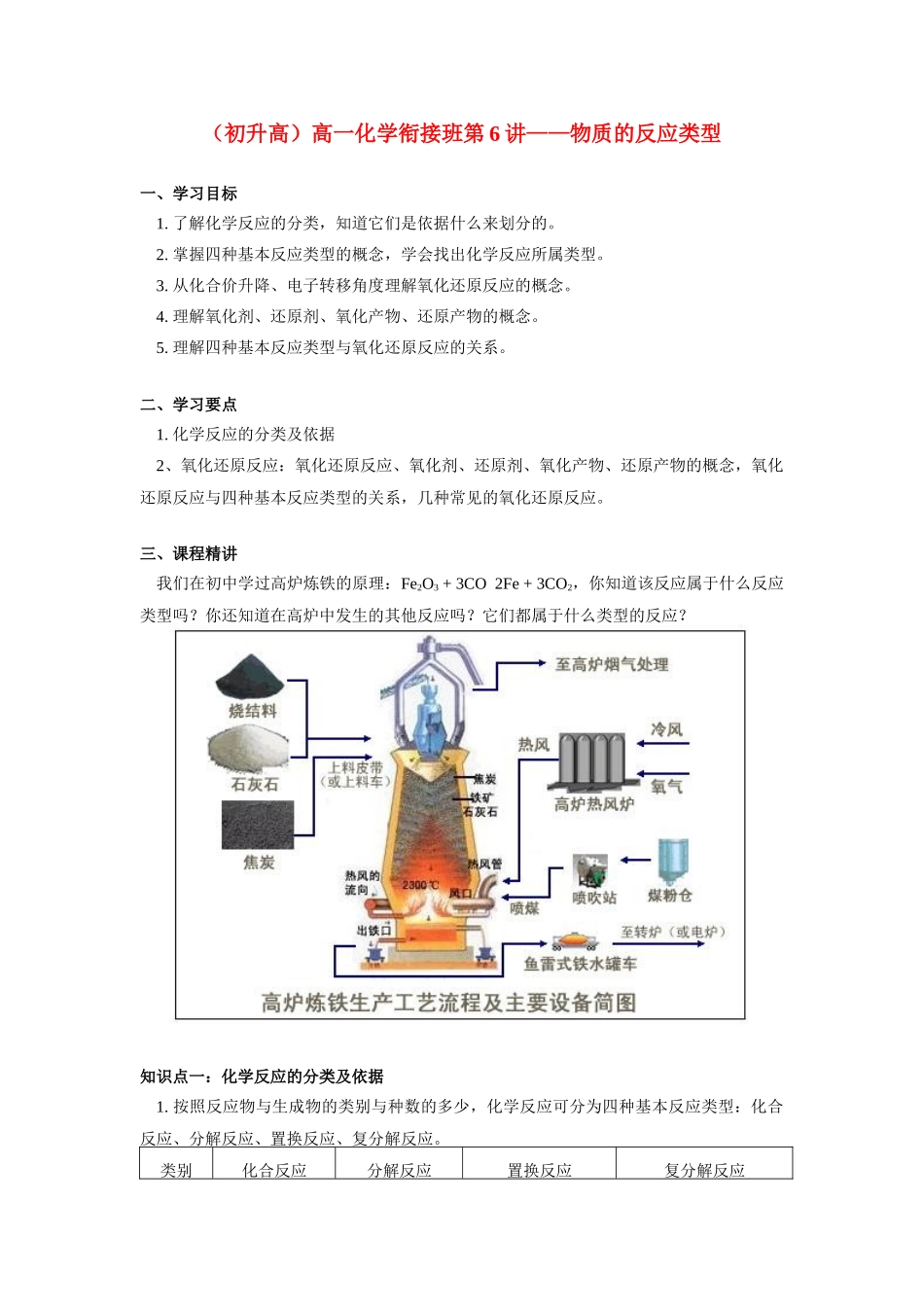
(初升高)高一化学衔接班第6讲——物质的反应类型一、学习目标1.了解化学反应的分类,知道它们是依据什么来划分的。2.掌握四种基本反应类型的概念,学会找出化学反应所属类型。3.从化合价升降、电子转移角度理解氧化还原反应的概念。4.理解氧化剂、还原剂、氧化产物、还原产物的概念。5.理解四种基本反应类型与氧化还原反应的关系。二、学习要点1.化学反应的分类及依据2、氧化还原反应:氧化还原反应、氧化剂、还原剂、氧化产物、还原产物的概念,氧化还原反应与四种基本反应类型的关系,几种常见的氧化还原反应。三、课程精讲我们在初中学过高炉炼铁的原理:Fe2O3+3CO2Fe+3CO2,你知道该反应属于什么反应类型吗?你还知道在高炉中发生的其他反应吗?它们都属于什么类型的反应?知识点一:化学反应的分类及依据1.按照反应物与生成物的类别与种数的多少,化学反应可分为四种基本反应类型:化合反应、分解反应、置换反应、复分解反应。类别化合反应分解反应置换反应复分解反应定义由两种或两种以上物质生成一种物质的反应。由一种物质生成两种或两种以上物质的反应。由一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应。由两种化合物互相交换成分,生成另外两种化合物的反应。表达式举例练习:指出下列化学反应各属于四种基本反应类型中的哪种类型。(1)CuSO4+BaCl2=BaSO4↓+CuCl2(2)Fe+2FeCl3=3FeCl2(3)Zn+2HCl=ZnCl2+H2↑(4)Cl2+H2O=HCl+HClO(5)CaCO3CaO+CO2↑(6)3Fe+2O2Fe3O4(7)CuO+H2SO4=CuSO4+H2O(8)Fe+CuSO4=FeSO4+Cu(9)CaCO3+CO2+H2O=Ca(HCO3)2(10)Fe2O3+3CO2Fe+3CO22.按是否有电子转移划分:氧化还原反应、非氧化还原反应3.按是否有离子参加划分:离子反应(电解质在水溶液中进行的反应)、分子反应(非离子反应)4.按反应进行程度划分:可逆反应、非可逆反应5.按反应的热效应划分:放热反应、吸热反应知识点二:氧化还原反应用四种基本反应类型的分类方法分析:化学反应Fe2O3+3CO2Fe+3CO2属于哪种类型的反应?它不属于四种基本反应类型中的任何一种,四种基本反应类型并不能包括所有的化学反应。1.氧化还原反应的概念人们常常根据化学反应过程中元素的化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反应。例如,铁与硫酸铜溶液发生如下反应:Fe+CuSO4=Cu+FeSO4,Fe转化为Fe2+,铁元素的化合价升高;Cu2+转化为Cu,铜元素的化合价降低。像这样有元素化合价发生变化的反应称为氧化还原反应,而元素化合价不发生变化的反应称为非氧化还原反应,如:CO2+2NaOH=Na2CO3+H2O是非氧化还原反应。在反应Fe+CuSO4=Cu+FeSO4中,铁元素的化合价由0价变为+2价,化合价升高了,我们称铁发生了氧化反应;铜元素的化合价由+2价变为0价,化合价降低了,我们称铜发生了还原反应。我们把物质所含元素化合价升高的反应称为氧化反应,把物质所含元素化合价降低的反应称为还原反应。发生氧化反应的物质在反应过程中被氧化;发生还原反应的物质在反应过程中被还原。这两个截然相反的过程是在一个反应中同时发生的。也就是说,有一种物质被氧化,必然有一种物质被还原。例如,反应Fe+CuSO4=Cu+FeSO4中,Fe发生了氧化反应,在反应过程中被氧化;CuSO4发生了还原反应,在反应过程中被还原。讨论:指出下列反应哪些是氧化还原反应,哪些不是氧化还原反应,是氧化还原反应的指出是哪种物质发生了氧化反应,哪种物质发生了还原反应,哪种物质被氧化,哪种物质被还原。(1)H2+CuOCu+H2O(2)CaCO3CaO+CO2↑(3)2Na+Cl22NaCl我们知道,元素化合价的升降与电子的得失或偏移有密切关系。那么,氧化还原反应与电子的转移有关系吗?有什么关系呢?我们以反应2Na+Cl22NaCl为例来分析。在氯气与氢气的反应中,由于生成的氯化氢是共价化合物,在电子转移过程中,两种元素的原子都没有完全失去或得到电子,它们之间只有共用电子对发生偏移,且共用电子对偏离氢原子而偏向氯原子。因此在HCl中,氢元素的化合价为+1价,氯元素的化合价为-1价。综上所述,我们可以给氧化还原反应下一个更加本质的定义:有电子转移(得失或偏移)的反应都是氧化还原反应。2.氧化还原反应与四...