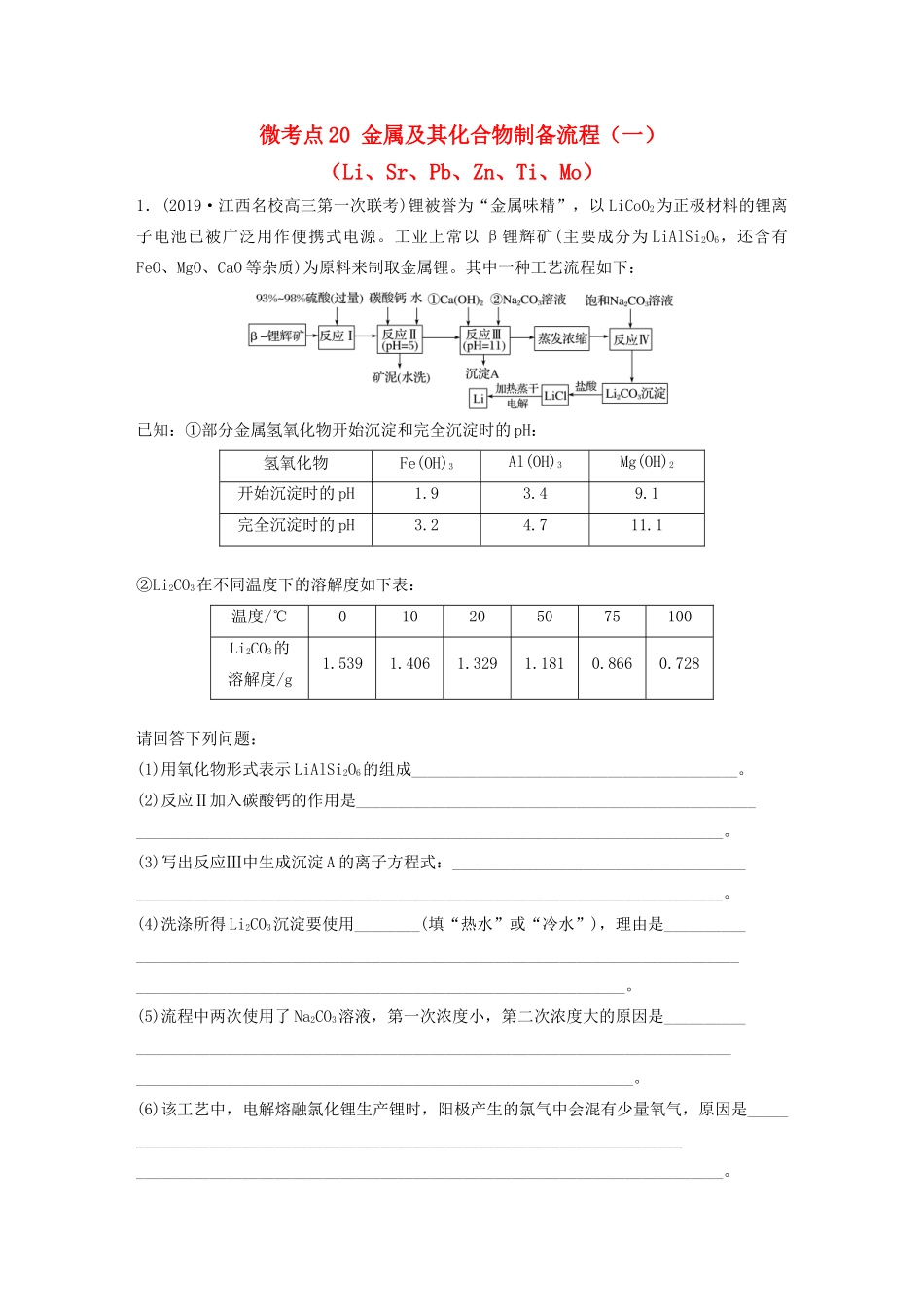
微考点20金属及其化合物制备流程(一)(Li、Sr、Pb、Zn、Ti、Mo)1.(2019·江西名校高三第一次联考)锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:氢氧化物Fe(OH)3Al(OH)3Mg(OH)2开始沉淀时的pH1.93.49.1完全沉淀时的pH3.24.711.1②Li2CO3在不同温度下的溶解度如下表:温度/℃010205075100Li2CO3的溶解度/g1.5391.4061.3291.1810.8660.728请回答下列问题:(1)用氧化物形式表示LiAlSi2O6的组成________________________________________。(2)反应Ⅱ加入碳酸钙的作用是_________________________________________________________________________________________________________________________。(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________________________________________________________________________________________________。(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),理由是________________________________________________________________________________________________________________________________________________。(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是________________________________________________________________________________________________________________________________________________。(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是________________________________________________________________________________________________________________________________________________。2.(2020·广州质检)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用碳酸锶(SrCO3)粉为原料(含少量钡和铁的化合物等)制备高纯六水氯化锶晶体的过程如下:已知:①M(SrCl2·6H2O)=267g·mol-1②Ksp(SrSO4)=3.3×10-7、Ksp(BaSO4)=1.1×10-10③经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+、Fe2+、Fe3+杂质④SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水请回答下列问题:(1)已知Sr为第五周期ⅡA族元素,则不符合Sr>Ca的是________(填序号)。①原子半径②最外层电子数③金属性④最高价氧化物对应的水化物的碱性(2)写出碳酸锶与盐酸反应的离子方程式:______________________________________________________________________________________________________________。(3)工业上用热风吹干六水氯化锶,适宜的温度是______(填字母)。A.50~60℃B.70~80℃C.80~100℃D.100℃以上(4)步骤④的操作是________________、____________、过滤。(5)加入硫酸的目的是________________________________________________________。(6)若滤液中Ba2+的浓度为1×10-5mol·L-1,依据题给信息计算滤液中Sr2+的物质的量浓度为________mol·L-1。3.(2020·大连模拟)用废铅蓄电池的铅泥(含PbSO4,PbO和Pb等)制备精细化工产品PbSO4·3PbO·H2O(三盐)的主要流程如下:已知:常温下,Ksp(PbSO4)≈2.0×10-8,Ksp(PbCO3)≈1.0×10-13。回答下列问题:(1)铅蓄电池在生活中有广泛应用,其工作原理是Pb+PbO2+2H2SO42PbSO4+2H2O。铅蓄电池在充电时,阳极的电极反应式为_______________________________________。若铅蓄电池放电前,正、负极电极质量相等,如果放电时转移了1mol电子,则理论上两电极质量之差为________。(2)将滤液1、滤液3合并,经蒸发浓缩、降温结晶、过滤等操作,得到一种结晶水合物(Mr=322),其化学式为____________________________。(3)步骤③酸溶时铅与硝酸反应生成Pb(NO3)2及NO的离子方程式为________________________________________________________________________;滤液2中溶质的主要成分为____________(写化学式)。(4)步骤⑥合成三盐的化学方...