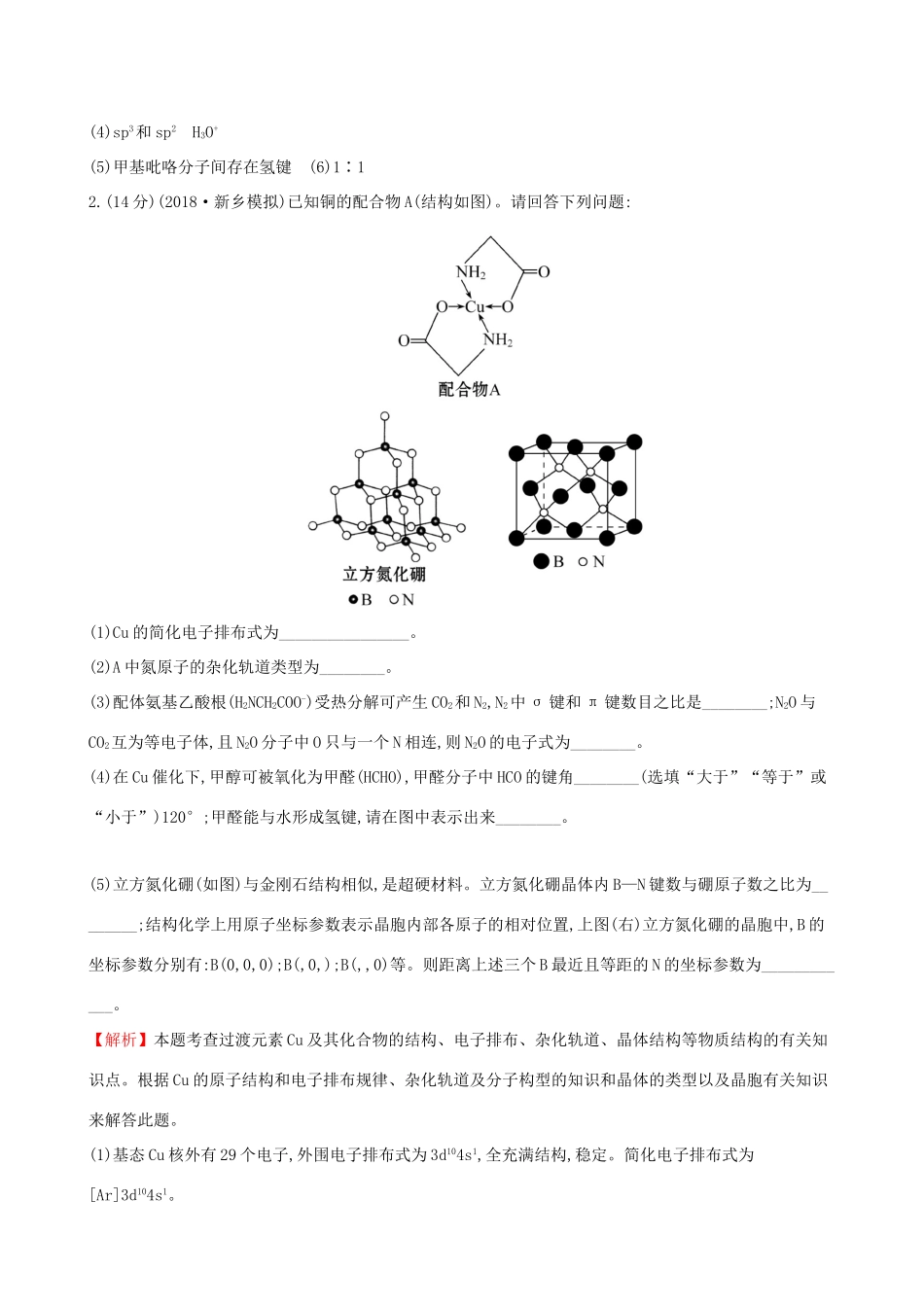
课时梯级作业四十二分子结构与性质(45分钟100分)非选择题(本题包括7小题,共100分)1.(14分)(2018·淮安模拟)甲基呋喃与氨在高温下反应得到甲基吡咯:(1)Zn的基态原子核外电子排布式为_______________________。(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是__________(填元素符号)。(3)1mol甲基呋喃分子中含有σ键的数目为__________mol。(4)甲基吡咯分子中碳原子轨道的杂化轨道类型是__________。与NH3分子互为等电子体的阳离子为__________。(5)甲基吡咯的熔沸点高于甲基呋喃的原因是______________________。(6)锌的某种化合物晶胞结构如图所示,则构成该化合物的两种粒子个数比为__________。【解析】(1)Zn的基态原子核外电子排布式为[Ar]3d104s2。(2)配合物[Zn(NH3)3(H2O)]2+中,与Zn2+形成配位键的原子是N和O。(3)分子中每两个相邻原子之间存在一个σ键,1mol甲基呋喃分子中含有σ键的数目为12mol。(4)甲基吡咯分子中单键碳原子杂化轨道类型是sp3,双键碳原子杂化轨道类型是sp2,总之,碳原子轨道的杂化轨道类型是sp3和sp2。等电子体是原子数相同、价电子总数相同的微粒,与NH3分子互为等电子体的阳离子为H3O+。(5)甲基吡咯的熔沸点高于甲基呋喃的原因是甲基吡咯分子间存在氢键。(6)晶胞含有4个Zn、4个X,则构成该化合物的两种粒子个数比为1∶1。答案:(1)[Ar]3d104s2(2)N和O(3)12(4)sp3和sp2H3O+(5)甲基吡咯分子间存在氢键(6)1∶12.(14分)(2018·新乡模拟)已知铜的配合物A(结构如图)。请回答下列问题:(1)Cu的简化电子排布式为________________。(2)A中氮原子的杂化轨道类型为________。(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比是________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为________。(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中HCO的键角________(选填“大于”“等于”或“小于”)120°;甲醛能与水形成氢键,请在图中表示出来________。(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B—N键数与硼原子数之比为________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B的坐标参数分别有:B(0,0,0);B(,0,);B(,,0)等。则距离上述三个B最近且等距的N的坐标参数为____________。【解析】本题考查过渡元素Cu及其化合物的结构、电子排布、杂化轨道、晶体结构等物质结构的有关知识点。根据Cu的原子结构和电子排布规律、杂化轨道及分子构型的知识和晶体的类型以及晶胞有关知识来解答此题。(1)基态Cu核外有29个电子,外围电子排布式为3d104s1,全充满结构,稳定。简化电子排布式为[Ar]3d104s1。(2)氮原子有4个杂化轨道,所以为sp3杂化。(3)N2的结构式为N≡N,含1个σ键和2个π键,所以σ键和π键数目比为1∶2,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O结构与CO2相似,所以其结构为NNO,电子式为(4)甲醛分子中,碳原子为sp2杂化,分子成平面三角形,键角约120°,由于氧原子有孤电子对,对氢原子有排斥作用,所以OCH键角会稍大于120°,羰基氧有很强的电负性,与H2O中H有较强的静电吸引力,而形成氢键。(5)由图可知,一个B与4个N形成4个B—N共价键,B—N键数与硼原子数之比为4∶1,根据各个原子的相对位置可知,距离上述三个B最近且等距的N在x、y、z轴三个方向的处,所以其坐标是(,,)。答案:(1)[Ar]3d104s1(2)sp3杂化(3)1∶2(4)大于(5)4∶1(,,)3.(18分)(2018·孝感模拟)目前半导体生产正在进行一场“铜芯片”革命:在硅芯片上用铜代替铝布线。古老的金属铜在现代科技应用上取得了突破。用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:(1)基态铜原子的价电子排布式为____________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是________,与该分子互为等电子体的单质气体的化学式是____________。(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液蓝色沉淀沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为_______________________...