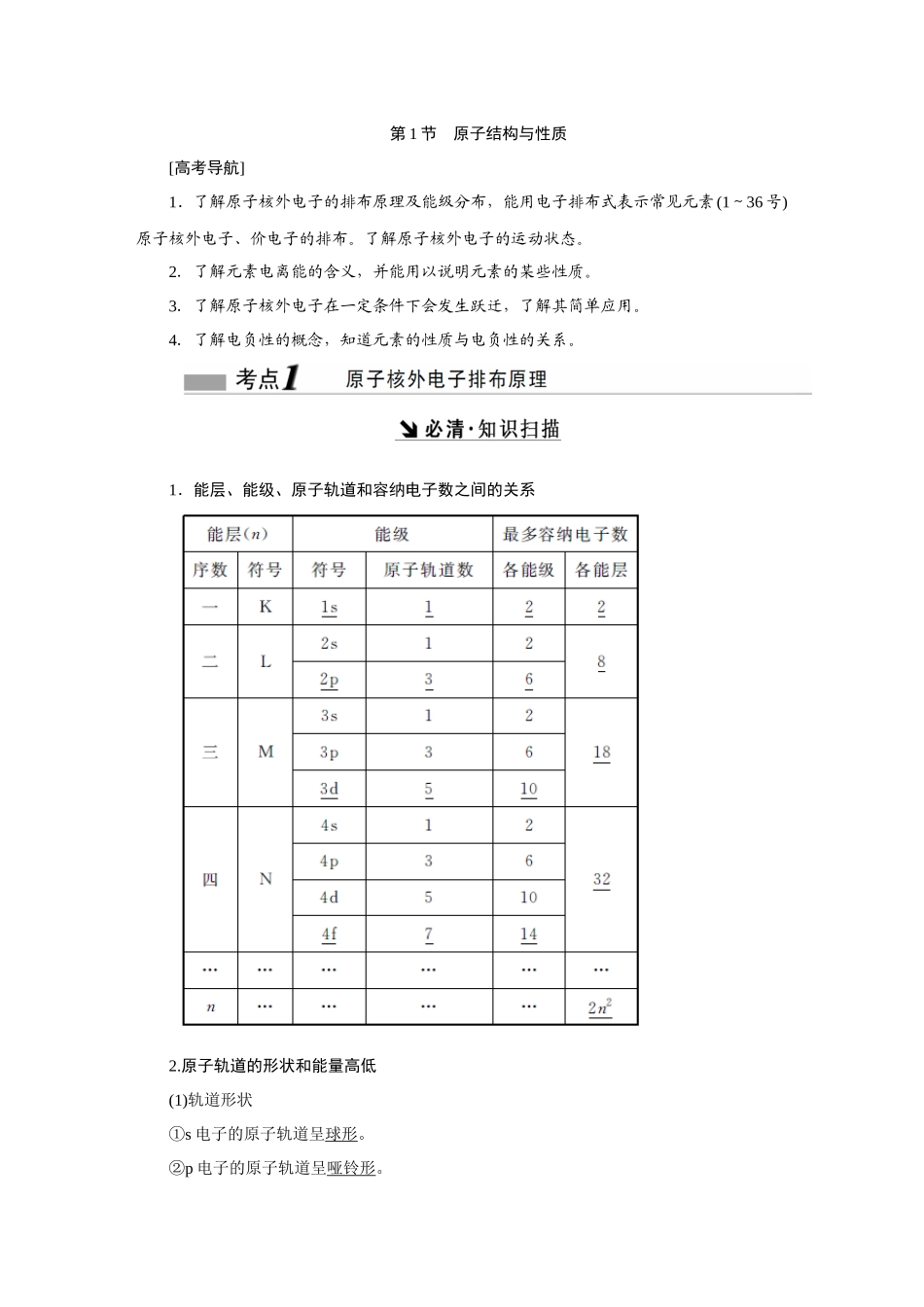
第 1 节 原子结构与性质[高考导航]1.了解原子核外电子的排布原理及能级分布,能用电子排布式表示常见元素(1~36 号)原子核外电子、价电子的排布。了解原子核外电子的运动状态。2.了解元素电离能的含义,并能用以说明元素的某些性质。3.了解原子核外电子在一定条件下会发生跃迁,了解其简单应用。4.了解电负性的概念,知道元素的性质与电负性的关系。1.能层、能级、原子轨道和容纳电子数之间的关系2.原子轨道的形状和能量高低(1)轨道形状①s 电子的原子轨道呈球形。②p 电子的原子轨道呈哑铃形。(2)能量高低① 相同能层上原子轨道能量的高低:n s< n p< n d< n f 。② 形状相同的原子轨道能量的高低:1s<2s<3s<4s<…。③ 同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如 npx、npy、npz轨道的能量相等。3.原子核外电子的排布规律 (1)三个原理① 能量最低原理:原子的核外电子排布遵循构造原理,使整个原子的能量处于 最低状态。构造原理示意图:② 泡利原理:在一个原子轨道里最多只能容纳 2 个电子,而且自旋方向相反。③ 洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先 单独占据一个轨道,而且自旋方向相同。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0 、 d0 、 f0) 状 态 时 , 体 系 的 能 量 最 低 。 如 24Cr 的 基 态 原 子 电 子 排 布 式 为 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 ,而不是 1s22s22p63s23p63d44s2。思考:Mn 的电子排布式能否书写为 1s22s22p63s23p64s23d5?提示:不能。当出现 d 能级时,虽然电子按 ns、(n-1)d、np 的顺序填充,但在书写电子 排 布 式 时 , 仍 把 (n - 1)d 放 在 ns 前 , 如 Mn : 1s22s22p63s23p63d54s2 正 确 , Mn :1s22s22p63s23p64s23d5错误。(2)基态原子核外电子排布的表示方法表示方法以硫原子为例电子排布式1s 2 2s 2 2p 6 3s 2 3p 4 简化电子排布式[Ne]3s 2 3p 4 电子排布图(轨道表示式)价电子排布式3s23p44.电子的跃迁与原子光谱(1)电子的跃迁① 基态→激发态:当基态原子的电子吸收能量后,会从低能级跃迁到较高能级,变成激发态原子。② 激发态→基态:激发态原子的电子从较高能级跃迁到低能级时会释放出能量。(2)原子光谱不同元素的原子发生跃迁时会吸收或释放不同的光,可...