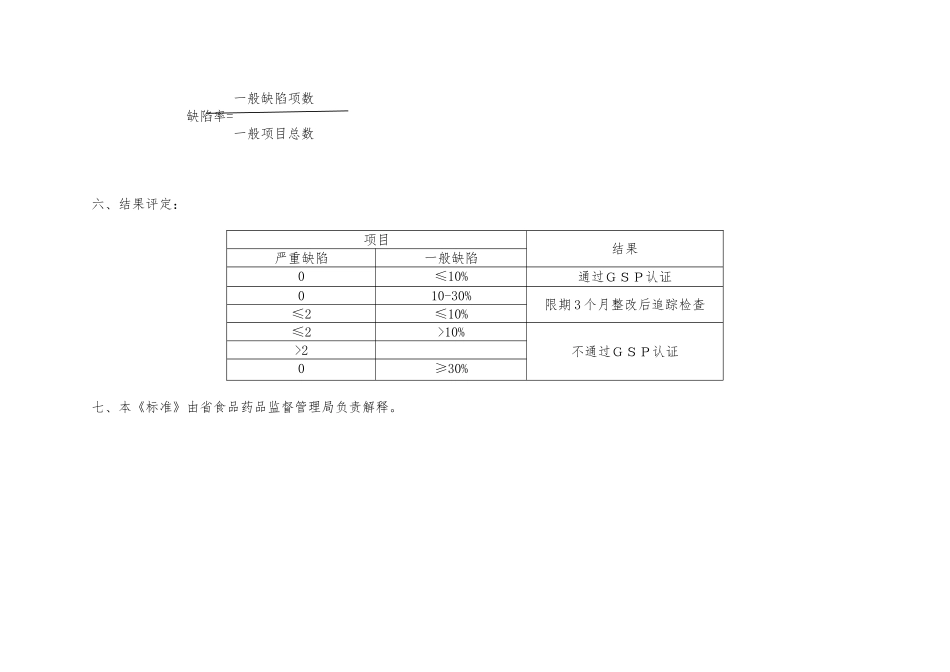
省体外诊断试剂经营企业(批发)GSP 认证检查评定标准省食品药品监督管理局制二○○七年十二月编 制 说 明一、为规本省体外诊断试剂经营企业(批发)的 GSP 认证检查,统一检查标准,根据国家食品药品监督管理局《关于印发体外诊断试剂经营企业(批发)验收标准和开办申请程序的通知》、《药品经营许可证管理办法》、《药品经营质量管理规》(2024.7.1)、《药品经营质量管理规实施细则》、《药品批发企业 GSP 认证检查评定标准》与《省体外诊断试剂经营企业(批发)验收标准细则》,特制定《省体外诊断试剂经营企业(批发)GSP 认证检查评定标准》(以下简称《标准》)。二、本《标准》适用于省辖区药品类体外诊断试剂经营企业(批发)的 GSP 认证检查。三、本《标准》分八个部分: 一、管理职责; 二、人员与培训; 三、设施与设备; 四、进货; 五、验收; 六、储存与养护;七、出库与运输;八、销售与售后服务。四、本标准共 96 项,其中关键条款(条款前加“*”)34 项,一般条款 62 项。五、现场检查认证时,检查组应对本标准所列项目与其涵盖的容进行全面检查,并逐项作出考核评定。凡全部达到项目容规定要求的 ,评定为合格项目;项目容不完整、不齐全的,评定为不合格项目。关键项目不合格为严重缺陷,一般项目不合格为一般缺陷。 一般缺陷项数缺陷率= 一般项目总数六、结果评定:项目结果严重缺陷一般缺陷0≤10%通过GSP认证010-30%限期 3 个月整改后追踪检查≤2≤10%≤2>10%不通过GSP认证>20≥30% 七、本《标准》由省食品药品监督管理局负责解释。第一部分:管理职责(共 17 条:其中带*号 6 条,不带*号 11 条)序号条款容*0401企业应根据依法批准的经营方式和经营围,从事体外诊断试剂经营活动。0501企业应建立以主要负责人为首,包括进货、销售、储运等业务部门负责人和企业质量管理机构负责人在的质量领导组织。0502企业质量领导组织的主要职责是:建立企业的质量体系,实施企业质量方针,保证企业质量管理工作人员行使职权。*0601企业应设置专门的质量管理机构,机构下设质量管理组(员)、质量验收组(员)。0602企业质量管理机构应行使质量管理职能,在企业部对体外诊断试剂质量具有裁决权。0603企业质量管理机构应负责起草企业体外诊断试剂质量管理制度,并指导、督促制度的执行。0604企业质量管理机构应负责首营企业和首营品种的质量审核。0605企业质量管理机构应负责建立企业所经营体...