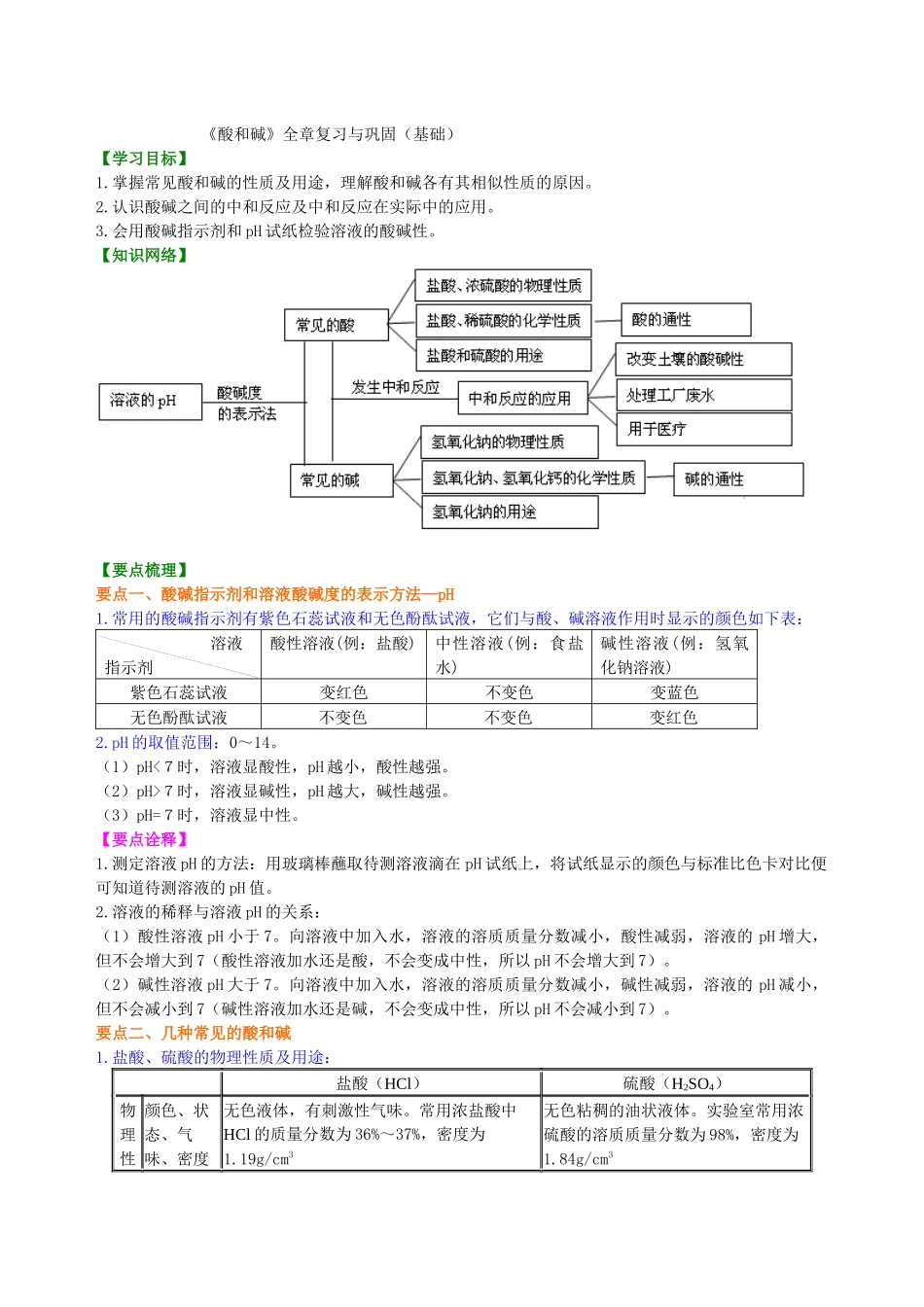
《酸和碱》全章复习与巩固(基础)【学习目标】1.掌握常见酸和碱的性质及用途,理解酸和碱各有其相似性质的原因。2.认识酸碱之间的中和反应及中和反应在实际中的应用。3.会用酸碱指示剂和 pH 试纸检验溶液的酸碱性。【知识网络】【要点梳理】要点一、酸碱指示剂和溶液酸碱度的表示方法—pH1.常用的酸碱指示剂有紫色石蕊试液和无色酚酞试液,它们与酸、碱溶液作用时显示的颜色如下表:溶液指示剂酸性溶液(例:盐酸)中性溶液(例:食盐水)碱性溶液(例:氢氧化钠溶液)紫色石蕊试液变红色不变色变蓝色无色酚酞试液不变色不变色变红色2.pH 的取值范围:0~14。(1)pH<7时,溶液显酸性,pH 越小,酸性越强。(2)pH>7时,溶液显碱性,pH 越大,碱性越强。(3)pH=7时,溶液显中性。【要点诠释】1.测定溶液 pH 的方法:用玻璃棒蘸取待测溶液滴在 pH 试纸上,将试纸显示的颜色与标准比色卡对比便可知道待测溶液的 pH 值。2.溶液的稀释与溶液 pH 的关系:(1)酸性溶液 pH 小于 7。向溶液中加入水,溶液的溶质质量分数减小,酸性减弱,溶液的 pH 增大,但不会增大到 7(酸性溶液加水还是酸,不会变成中性,所以 pH 不会增大到 7)。(2)碱性溶液 pH 大于 7。向溶液中加入水,溶液的溶质质量分数减小,碱性减弱,溶液的 pH 减小,但不会减小到 7(碱性溶液加水还是碱,不会变成中性,所以 pH 不会减小到 7)。要点二、几种常见的酸和碱1.盐酸、硫酸的物理性质及用途: 盐酸(HCl)硫酸(H2SO4)物理性颜色、状态、气味、密度无色液体,有刺激性气味。常用浓盐酸中HCl 的质量分数为 36%~37%,密度为1.19g/cm3无色粘稠的油状液体。实验室常用浓硫酸的溶质质量分数为 98%,密度为1.84g/cm3质 打开瓶盖后的现象浓盐酸在打开瓶盖后瓶口上方会出现白雾无明显现象用途盐酸是一种重要的化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中也含有少量的盐酸,可以帮助消化硫酸是一种重要的化工原料。用于生产化肥、农药、火药、染料、冶炼金属、精炼石油和金属除锈等;利用浓硫酸的吸水性,实验室中常用它做干燥剂2.氢氧化钠和氢氧化钙的物理性质、用途及制备原理: 氢氧化钠(N a OH)氢氧化钙(Ca(OH)2)俗称火碱、烧碱、苛性钠熟石灰、消石灰物理性质 白色固体,易溶于水,易潮解,溶解时放出大量的热。N a OH固体有吸水性白色固体,微溶于水用途重要的化工原料,应用于肥皂、石油...