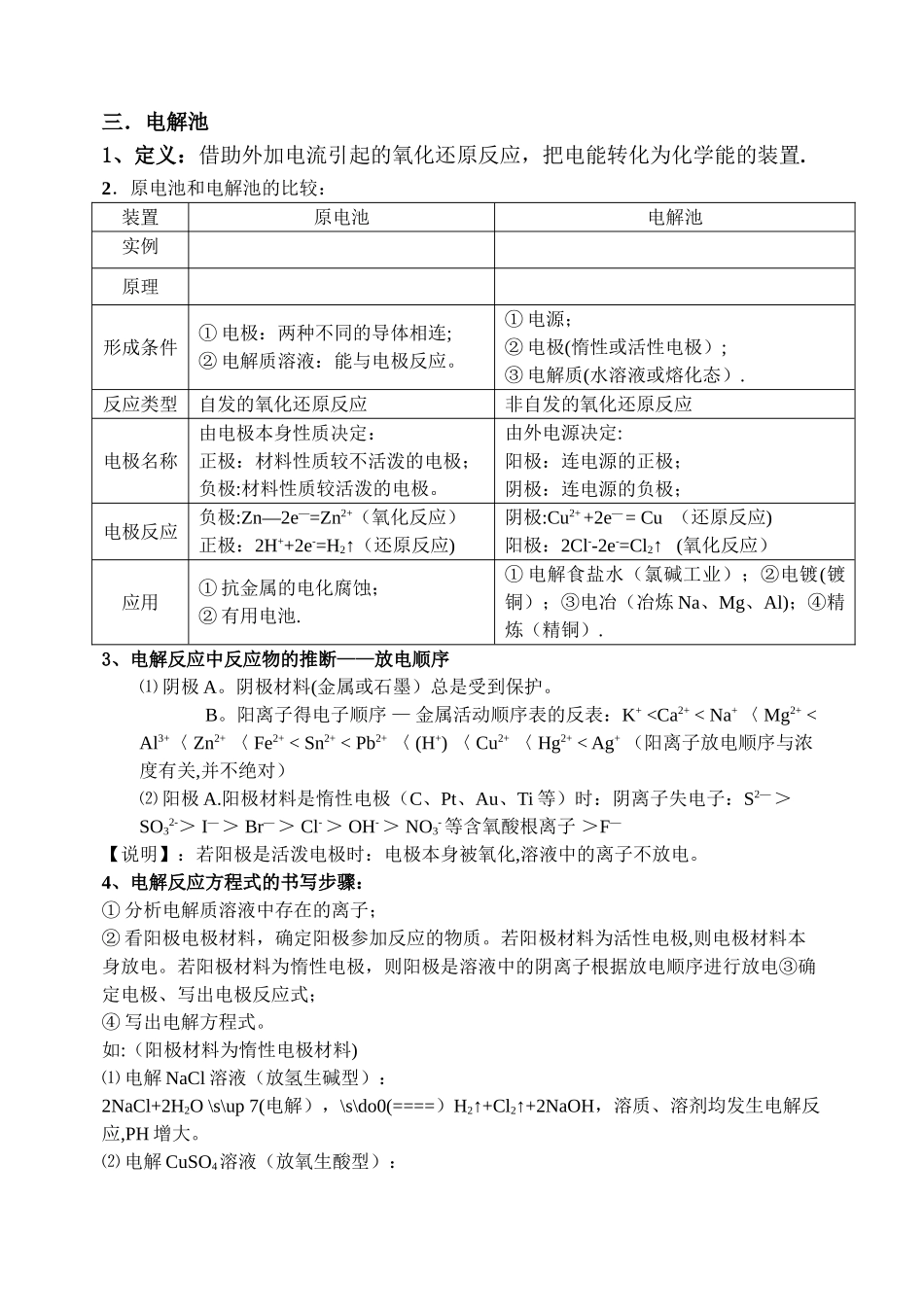
三.电解池1、定义:借助外加电流引起的氧化还原反应,把电能转化为化学能的装置.2.原电池和电解池的比较:装置原电池电解池实例原理形成条件① 电极:两种不同的导体相连;② 电解质溶液:能与电极反应。① 电源;② 电极(惰性或活性电极);③ 电解质(水溶液或熔化态).反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn—2e—=Zn2+(氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e— = Cu (还原反应)阳极:2Cl--2e-=Cl2↑ (氧化反应)应用① 抗金属的电化腐蚀;② 有用电池.① 电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼 Na、Mg、Al);④精炼(精铜).3、电解反应中反应物的推断——放电顺序⑴ 阴极 A。阴极材料(金属或石墨)总是受到保护。B。阳离子得电子顺序 — 金属活动顺序表的反表:K+