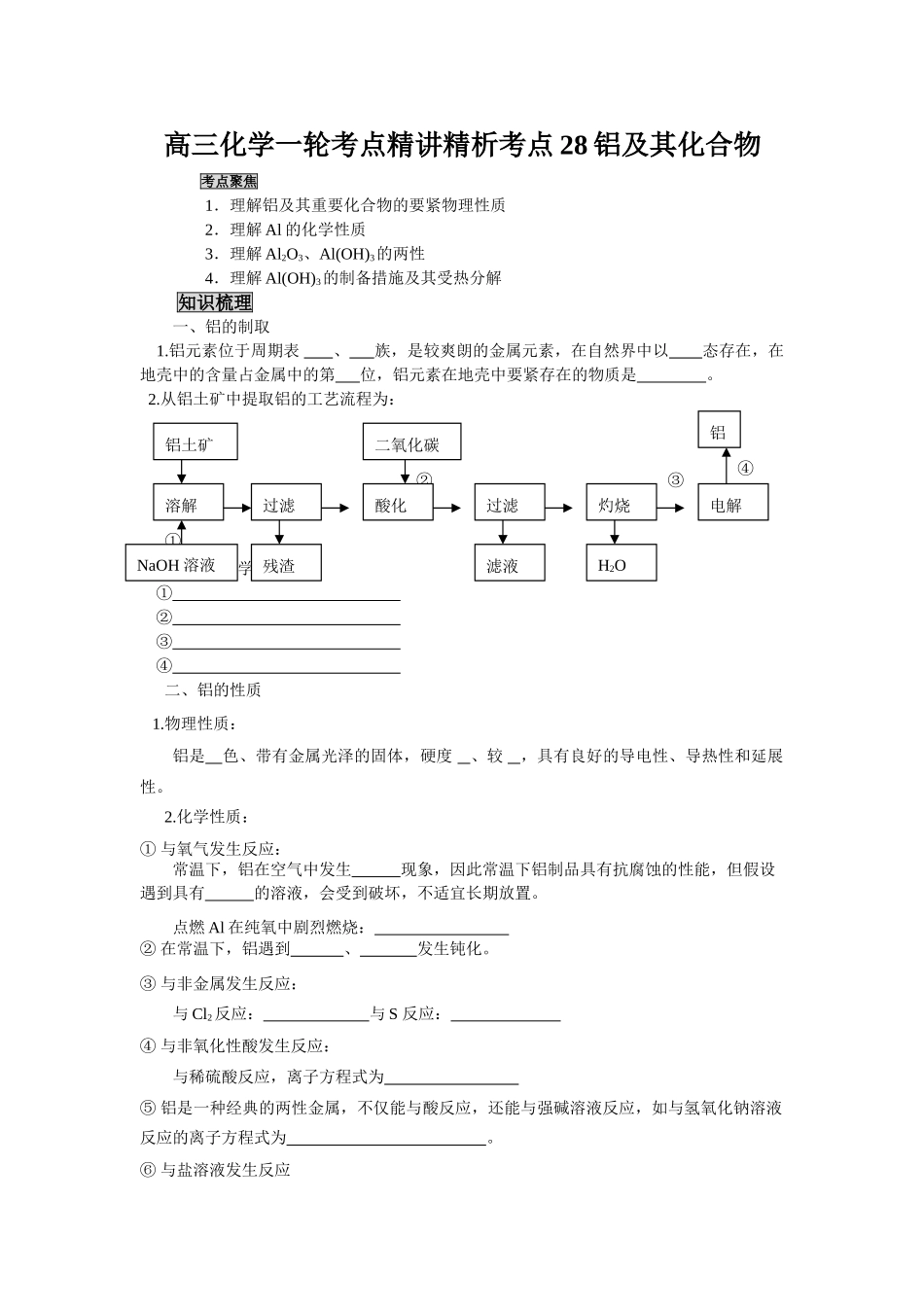
高三化学一轮考点精讲精析考点 28 铝及其化合物考点聚焦1.理解铝及其重要化合物的要紧物理性质2.理解 Al 的化学性质3.理解 Al2O3、Al(OH)3的两性4.理解 Al(OH)3的制备措施及其受热分解知识梳理一、铝的制取 1.铝元素位于周期表 、 族,是较爽朗的金属元素,在自然界中以 态存在,在地壳中的含量占金属中的第 位,铝元素在地壳中要紧存在的物质是 。 2.从铝土矿中提取铝的工艺流程为:写出反应的化学方程式:① ② ③ ④ 二、铝的性质 1.物理性质:铝是 色、带有金属光泽的固体,硬度 、较 ,具有良好的导电性、导热性和延展性。2.化学性质: ① 与氧气发生反应:常温下,铝在空气中发生 现象,因此常温下铝制品具有抗腐蚀的性能,但假设遇到具有 的溶液,会受到破坏,不适宜长期放置。点燃 Al 在纯氧中剧烈燃烧: ② 在常温下,铝遇到 、 发生钝化。③ 与非金属发生反应:与 Cl2 反应: 与 S 反应: ④ 与非氧化性酸发生反应:与稀硫酸反应,离子方程式为 ⑤ 铝是一种经典的两性金属,不仅能与酸反应,还能与强碱溶液反应,如与氢氧化钠溶液反应的离子方程式为 。⑥ 与盐溶液发生反应④②①③铝土矿溶解NaOH 溶液过滤残渣酸化二氧化碳过滤滤液灼烧H2O电解铝与不爽朗金属的盐溶液〔如硝酸汞〕: 与强氧化性盐溶液〔如氯化铁〕: ⑦ 与金属氧化物反应〔又叫 〕 与氧化铁: 三、铝的化合物 1.氧化铝①)物理性质Al2O3是 固体,其天然晶体叫 ,硬度大,熔点高(为 2072℃),是专门好的耐火材料② 化学性质〔经典的 氧化物〕与强酸反应,其离子方程式为 与强碱溶液反应,其离子方程式为 探索:铝与强碱溶液反应的实质是什么?标出其电子转移方向和数目。③ 用途 作 材料,如制 、 等;作冶炼铝的原料;红、蓝宝石。 2.氢氧化铝①)物理性质Al(OH)3是 固体, 溶于水,假设溶液中生成,Al(OH)3为 物,且有吸附水中悬浮物和色素的能力② 化学性质〔经典的 氢氧化物〕H++AlO2-+H2O Al(OH)3 Al3++3OH-与强酸反应,其离子方程式为 与强碱溶液反应,其离子方程式为 热不稳固性: ③ 制备措施:试验室中制取少许的氢氧化铝常用可溶性的铝盐与 反应,反应的离子方程 式为 。探索:能否用可溶性的铝盐与强碱反应制取?3.铝盐和偏铝酸盐 (1) 铝盐性质:① 铝盐溶液发生水解反应,使溶液呈酸性。 探索:明矾的化学式为 ,在平常生活中明矾用于 。②铝盐与碱溶液反应与强碱溶液...